Правило фаз Гиббса. Условия термодинамического равновесия однофазной и многофазных систем
Разобьем мысленно систему на две подсистемы (') и (") (рис.5.1), для каждой из которых известны все термодинамические параметры, причем Для каждой из подсистем, находящихся в состоянии равновесия, запишем уравнения Гиббса:
Просуммируем почленно эти два выражения:
С другой стороны, для изолированной равновесной системы
и
Ввиду произвольности значений дифференциалов
Рассмотрим однокомпонентную систему, состоящую из двух взаимодействующих фаз и заключенную в изолирующую оболочку. Пусть каждая из фаз находится в своем внутреннем равновесии, т.е. характеризуется своим набором интенсивных и экстенсивных параметров. При малом изменении состояния каждой из фаз можно записать для них термодинамические тождества
В силу аддитивности
и после почленного суммирования равенств получим
В силу произвольности дифференциалов
Химический потенциал по определению сам является функцией "естественной" пары переменных
Вид функций Состояние равновесия двухфазной системы называется состоянием насыщения, а равные для фаз температура и давление – параметрами насыщения. 5.4.4. Уравнение Клапейрона – Клаузиса В дальнейшем будем рассматривать только фазовые переходы I рода, во время которых происходит изменение агрегатного состояния, а точнее, переход "жидкость–пар", который весьма часто имеет место в тепловых машинах. Формула Клапейрона–Клаузиуса связывает температуру насыщения (температуру кипения) T s с давлением насыщения p s. Для нахождения этой зависимости запишем в дифференциальной форме условие равновесия фаз:
или
Так как химический потенциал совпадает с удельной свободной энергией Гиббса
откуда
Учтя определение удельной теплоты парообразования, получаем зависимость, известную как формула Клапейрона - Клаузиуса
Так как Лекция 11
|

 В качестве примера применения термодинамических методов исследования получим условия термодинамического равновесия однофазной изолированной системы.
В качестве примера применения термодинамических методов исследования получим условия термодинамического равновесия однофазной изолированной системы.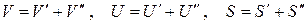 .
.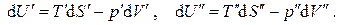
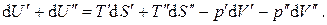
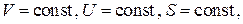 тогда
тогда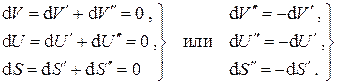
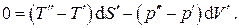
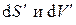 , из последнего выражения находим условия термодинамического равновесия изолированной системы:
, из последнего выражения находим условия термодинамического равновесия изолированной системы: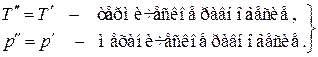
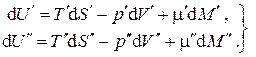 .
.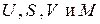 , замкнутости системы и обратимости процесса имеем
, замкнутости системы и обратимости процесса имеем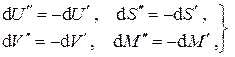
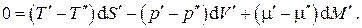
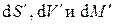 множители в скобках при этих дифференциалах должны быть равны нулю, откуда получаем условия термодинамического равновесия двухфазной однокомпонентной системы:
множители в скобках при этих дифференциалах должны быть равны нулю, откуда получаем условия термодинамического равновесия двухфазной однокомпонентной системы: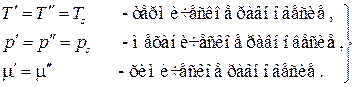
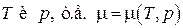 , таким образом, условие равновесия фаз может быть записано в виде
, таким образом, условие равновесия фаз может быть записано в виде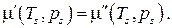
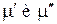 от T и p в общем случае различен для каждой из фаз, поэтому последнее условие не является тождеством. Это есть алгебраическое уравнение, связывающее температуру и давление в равновесной двухфазной системе. Таким образом, в двухфазной однокомпонентной системе температура и давление однозначно связаны. Объем же системы может принимать произвольное значение в зависимости от соотношения между массами фаз.
от T и p в общем случае различен для каждой из фаз, поэтому последнее условие не является тождеством. Это есть алгебраическое уравнение, связывающее температуру и давление в равновесной двухфазной системе. Таким образом, в двухфазной однокомпонентной системе температура и давление однозначно связаны. Объем же системы может принимать произвольное значение в зависимости от соотношения между массами фаз.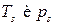 (s aturation ≡ насыщение).
(s aturation ≡ насыщение).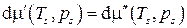
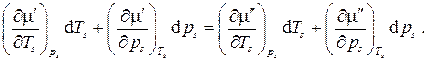
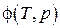 , то
, то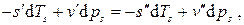
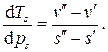
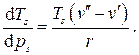
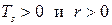 , а удельный объем в парообразном состоянии больше, чем в жидком, температура кипения увеличивается с увеличением давления.
, а удельный объем в парообразном состоянии больше, чем в жидком, температура кипения увеличивается с увеличением давления.


