Равновесие химико-технологических процессов.
Любой химико-технологический процесс в зависимости от условий его осуществления может быть обратимым, то есть протекать как в сторону образования исходных веществ, так и в сторону продуктов. Если условия проведения процесса таковы, что равновесие смещено в сторону образования продуктов, мы считаем, что процесс является необратимым. Если равновесие смещено в сторону образования исходных веществ, следовательно, реакция термодинамически запрещена (например, реакция взаимодействия кислорода и азота при комнатной температуре). Получается,что существует состояние равновесия, которое характеризуется следующими свойствами: 1) Скорость реакции в прямом направлении численно равна скорости реакции в обратном направлении. 2) Состав реакционной смеси в состоянии равновесия не изменяется при постоянстве внешних условий. 3) При изменении внешних условий равновесие смещается в соответствии с принципом Ле-Шателье-Брауна, который можно сформулировать следующим образом: Если систему, находящуюся в равновесии подвергнуть внешнему воздействию, то система будет компенсировать это внешнее воздействие. 4) Энергия Гиббса реагирующей системы в состоянии равновесия равна 0. аА + bB Реакция является формально простой, то есть протекает без промежуточных соединений. Порядок реакций по каждому компоненту будет численно совпадать с его молекулярностью, в этом случае скорость реакции в прямом направлении мы можем записать в соответствии с законом действующих масс:
Где В соответствии с законом Дальтона, парциальное давление любого i-того компонента есть произведение общего давления на мольную долю этого компонента в смеси: Pi = P ∙ Zi При выполнении термодинамического анализа используется величина приведенного безразмерного давления, то есть величина выраженная в атмосферах и отнесенная к одной атмосфере: Р =
K = ЕА – энергия активации [ 1)К0 – предэкспоненциальный множитель – это величина, связанная с изменением энтропии реагирующей системы, физический смысл – максимальное возможное значение константы скорости реакции. С точки зрения абсолютной шкалы температура достигается в районе 5000 К, отсюда понятна перспективность различных плазмохимических производств и процессов.
Компенсационный эффект – чем выше энергия активации, тем выше величина К0 , снижая энергию активации, снижается максимальное возможное значения константы скорости. 2)Произведение мольных долей компонентов отвечает за влияние состава реакционной смеси на скорость реакции. Очевидно, чем больше произведение мольных долей исходных компонентов, тем больше скорость реакции. 3)Давление показывает каким образом величина скорости будет изменяться с увеличением давления. Чем больше суммарная молекулярность, тем интенсивнее воздействие давления на скорость. Она будет увеличиваться.
Где В соответствии с равновесием:
Где Кр – термодинамическая константа равновесия. Используя уравнение Аррениуса:
С точки зрения термодинамики:
R = 8.31
Составляя уравнения, полученных на основе кинетических и термодинамических закономерностей, мы можем сделать заключение, что величина предэкспоненциального множителя К0 связана с изменением энтропии реагирующей системы, а также изменение энтальпии реагирующей системы численно равна разности энергий активации прямой и обратной реакции:
Для экзотермической реакции: Для эндотермической реакции: По величинам энергии активации можно определить величину теплового эффекта реакции (второй вариант определения
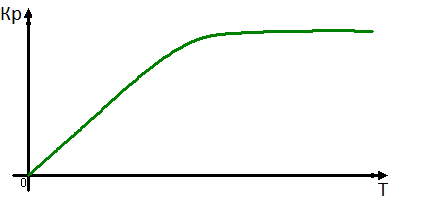
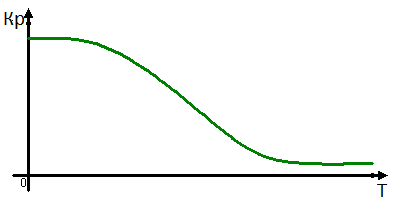
Это уравнение показывает как будет изменяться величина константы равновесия в зависимости от знака теплового эффекта реакции. Если экзотермическая реакция, то производная будет меньше нуля, и константа равновесия с уменьшением температуры будет уменьшаться. Для эндотермической реакции константа равновесия с увеличением температуры будет увеличиваться, так как производная больше 0. 1)
2)
|

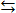 cC + dD
cC + dD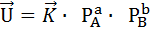
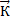 – константа скорости реакции в прямом направлении; Р – парциальное давление коэффициентов А и В
– константа скорости реакции в прямом направлении; Р – парциальное давление коэффициентов А и В
 =
=  ∙
∙  ∙
∙ 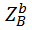 ∙
∙ 
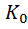 ∙
∙  – Уравнение Аррениуса
– Уравнение Аррениуса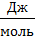 ] Физический смысл - минимальный избыток энергии, который необходимо сообщить реагирующей системе, чтобы произошел элементарный акт химической реакции. Чем больше ЕА ,тем при большей температуре константа скорости достигает приемлемых значений для проведения промышленного процесса. Снижение энергии активации достигается при изменении маршрута протекания реакции за счет использования катализаторов. Но следует помнить, что существенное снижение энергии активации приводит к тому, что при изменении температуры, константа скорости изменяется незначительно, в результате чего технолог теряет интенсивность воздействия температуры на процесс.
] Физический смысл - минимальный избыток энергии, который необходимо сообщить реагирующей системе, чтобы произошел элементарный акт химической реакции. Чем больше ЕА ,тем при большей температуре константа скорости достигает приемлемых значений для проведения промышленного процесса. Снижение энергии активации достигается при изменении маршрута протекания реакции за счет использования катализаторов. Но следует помнить, что существенное снижение энергии активации приводит к тому, что при изменении температуры, константа скорости изменяется незначительно, в результате чего технолог теряет интенсивность воздействия температуры на процесс.

 – скорость реакции в обратном направлении;
– скорость реакции в обратном направлении;




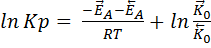
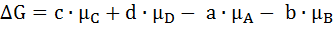

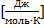 - универсальная газовая постоянная.
- универсальная газовая постоянная.
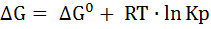
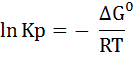





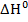 )
)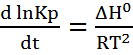 – Уравнение изобары Вант-Гоффа
– Уравнение изобары Вант-Гоффа