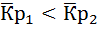Анализ изменения состояния равновесия при проведении реакции
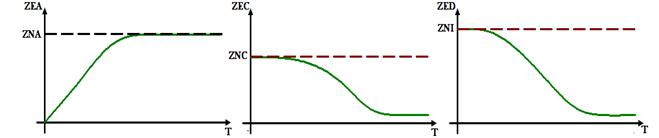
1) А + B А Реакции экзотермические, идут с уменьшением числа молей.
Обе реакции экзотермические, поэтому при увеличении температуры равновесие обеих реакций по принципу Ле-Шателье-Брауна будет смещаться в сторону образования исходных веществ. Равновесная мольная доля компонента А будет увеличиваться, равновесные мольные доли компонентов С и D – уменьшаться. В соответствии с графиками, средняя значение величины константы равновесия в первой реакции в рассмотренном диапазоне изменения температур будет меньше, чем среднее значение величины константы равновесия второй реакции.
2) А + B А Условия: первая реакция экзотермическая, вторая – эндотермическая, обе идут с уменьшением числа молей
Первая реакция экзотермическая, следовательно, по принципу Ле-Шателье-Брауна равновесие при повышении температуры будет смещаться в сторону образования исходных веществ. Равновесная мольная доля компонента С будет уменьшаться, компонента А – увеличиваться. Вторая реакция эндотермическая, следовательно, при повышении температуры равновесие будет смещаться в сторону образования продуктов. Равновесная мольная доля компонента D будет увеличиваться, компонента А – уменьшаться. Т=const 2А + B А Условия: первая реакция экзотермическая (0<W<1); вторая - эндотермическая(W>1).Т=const
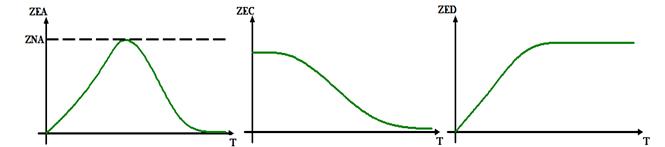
В соответствии с принципом Ле-Шателье, равновесие первой реакции будет смещаться в сторону образования продуктов, следовательно равновесная мольная концентрация компонента А уменьшается. Равновесие второй реакции смещается в сторону образования исходных веществ, то есть равновесная мольная концентрация компонента А будет увеличиваться. На вторую реакцию действуют два фактора – давление и увеличение мольной доли компонента С.
|

 C
C