КИНЕТИКА РАЗЛОЖЕНИЯ МУРАВЬИНОЙ КИСЛОТЫ
Вопросы для самоподготовки: 1). Основной постулат химической кинетики. Скорость константа скорости молекулярность и порядок реакции. 2). Методы определения порядка химической реакции. 3). Кинетические уравнения необратимых и обратимых реакций первого порядка. 4). Температурная зависимость константы скорости реакции. Правило Вант-Гоффа. 5) Энергетический профиль гомогенной химической реакции. Энергия активации реакции. 5). Вывод уравнения Аррениуса в дифференциальной и интегральной форме.
Литература Курс физической химии / Под ред. Я.И. Герасимова. Т II. М.: Химия, 1973. С. 13-24, 39-43. Скорость химического процесса может быть определена изменением концентрации любого из веществ, участвующих в реакции, в единицу времени. Для реакции первого порядка скорость v определяется уравнением: Интегрируя это уравнение, получаем
Значение постоянной интегрирования определяется из начальных условий. Для t = 0, с = с0 и const = ln c0 окончательно получаем:
Здесь с0 - начальная концентрация распадающегося вещества, с - концентрация его к моменту времени t от начала реакции. Из кинетического уравнения следует, что размерность константы скорости для реакции первого порядка - [время-1]. Зависимость скорости реакции от температуры описывается уравнением Аррениуса:
в котором Т - температура, К; R - универсальная газовая постоянная; Е - энергия активации реакции (под энергией активации понимают минимальную энергию, которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции). Определение энергии активации возможно по экспериментальным данным с использованием интегральной формы уравнения Аррениуса. Интегрирование уравнения Аррениуса в пределах от Т1 до Т2 дает:
где Е выражена в кал/моль. По этому уравнению можно рассчитать энергию активации, используя значения констант скоростей, определенных для двух температур. Температурным коэффициентом реакции g (коэффициентом Вант-Гоффа) называется отношение скоростей реакции (или констант скорости) при двух температурах T1 и T2, где T2 = T1 + 10. Для произвольной разницы температур можно записать:
В работе изучается разложение муравьиной кислоты под действием концентрированной серной кислоты. Изучаемая реакция является реакцией первого порядка и описывается следующим уравнением:
О ее скорости можно судить по количеству выделяющегося монооксида углерода. Так как число молей газа при постоянном давлении пропорционально его объему, то текущую концентрацию НСООН можно выразить через объем окиси углерода, полученной за время от начала реакции, а начальную концентрацию муравьиной кислоты можно определить по объему СО, выделившегося к концу реакции. Тогда для константы скорости имеем:
где V - объем монооксида углерода, выделившегося в результате протекания реакции к моменту времени t; V¥ - объем СО, выделившегося к моменту завершения реакции. Работа производится на установке, схема которой изображена на рисунке 1.
Рис.1 Схема установки Методика выполнения работы. 1. Нагревают водяную баню 1 до заданной температуры и выдерживают ее постоянной. В это же время открывают кран 2 и при помощи уравнительной склянки 3 доводят уровень жидкости в мерном сосуде 4 до верхней нулевой отметки, после чего кран перекрывают. 2. В реакционную колбу 5 наливают 20 мл концентрированной серной кислоты (r=1,84) и помещают в водяную баню. 3. После того, как кислота нагреется до заданной температуры (примерно через 10 минут), приливают к ней 0,3 мл муравьиной кислоты. Колбу плотно закрывают пробкой, смесь энергично перемешивают встряхиванием и колбу помещают в термостат. Кран - закрывают, чтобы реакционная колба 5 была соединена с мерным сосудом 4. Этот момент считается началом реакции. 4. Поднимая или опуская уравнительную склянку регулируют уровень жидкости, измеряю объем выделившегося газа. В течение всего опыта поддерживают давление внутри реакционной системы равным атмосферному, о чем судят по равенству жидкости в обоих коленах манометра 6. 5. Измеряют объем СО, выделившегося через каждые 5 минут, а также объем, отвечающий полному разложению муравьиной кислоты. Перед каждым замером выделившегося газа реакционную колбу следует несколько раз встряхнуть. Замеры проводят до тех пор, пока выделение газа не прекратится. Это время принимают за t¥ и отмечают соответствующий объем V¥. При комнатной температуре реакция заканчивается примерно через час. 6. Изучение скорости реакции разложения муравьиной кислоты проводят при нескольких температурах, указанных преподавателем. Обработка результатов 1. Опытные данные и вычисленные по ним величины констант скорости заносят в таблицу:
2. По значениям константы скорости для различных моментов времени вычисляют среднее её значение и доверительный интервал при данной температуре. 3. По уравнениям (2) и (3) рассчитывают кажущуюся энергию активации реакции разложения муравьиной кислоты Е и температурный коэффициент реакции g соответственно. Вычисляют погрешность определения энергии активации. 4. Формулируют выводы.
|

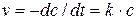
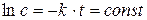

 , (1)
, (1) (2)
(2)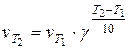 или
или 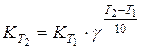 (3)
(3)
 (4)
(4)



