Ипсо-нитрование
Обобщенный механизм электрофильного замещения предполагает, что можно заместить не только водород, но и другую группу, если электрофильный агент атакует атом углерода, имеющий заместитель. Такие реакции получили название ипсо-замещения. Среди других реакций электрофильного замещения ипсо-замещение чаще всего наблюдалось в реакциях нитрования при несогласованной ориентации двух разветвленных алкильных групп в пара- или орто-положении. Вторичная или третичная алкильная группа отщепляется при этом в виде карбокатиона, который стабилизируется, теряя протон. Типичным примером такого процесса является нитрование 1,4-диизопропилбензола или 1,4-ди-трет-бутилбензола в классических условиях смесью азотной и серной кислот.
Известны примеры ипсо-замещения брома и иода, но не хлора или фтора, так как сама нитрогруппа является лучшей уходящей группой по сравнению со фтором или хлором.
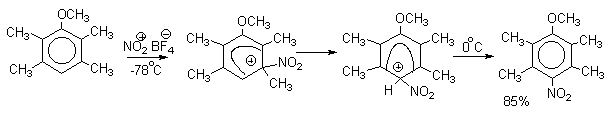
Следует четко различать ипсо-замещение и ипсо-атаку при электрофильном замещении, поскольку ипсо-атака совсем не обязательно приводит к ипсо-замещению. Рассмотрим это на конкретном примере нитрования 2,3,5,6-тетраметиланизола фторборатом нитрония. При низкой температуре -60оС в сильнокислой среде образуется ипсо-
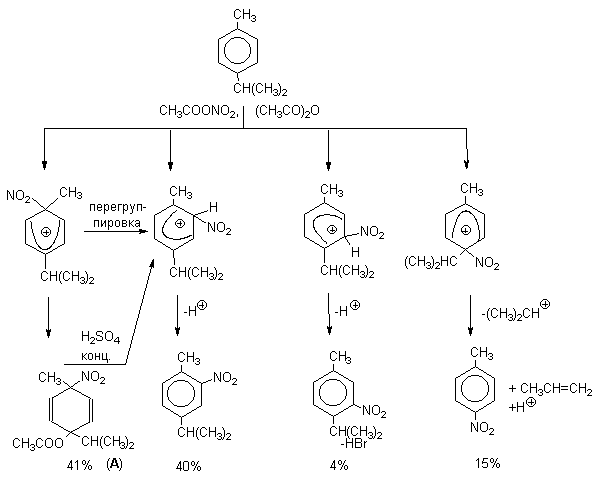
При нитровании пара-цимола (4-изопропилтолуола) фторборатом нитрония получается 85.2% 2-нитро-пара-цимола; 5.3% 3-нитро-пара-цимола и 9.5% 4-нитротолуола - продукта ипсо-замещения изопропильной группы. Аналогичное соотношение продуктов получается при нитровании пара-цимола нитрующей смесью. Однако при нитровании пара-цимола ацетилнитратом в уксусном ангидриде наряду с указанными продуктами в значительном количестве (41%) образуются цис- и транс-изомеры 4-ацетокси-4-изопропил-1-метил-1-нитро-циклогексадиена-2,5 (А), а выход 2-нитро-пара-цимола уменьшается до 40%. Это означает, что ипсо-
Следовательно, самым реакционноспособным положением в молекуле пара-цимола по отношению к электрофильной атаке катионом нитрония оказывается положение I и факторы парциальных скоростей четырех положений пара-цимола относятся как 10:5:1:2,5.Отсюда также следует, что при нитровании 1.4-диалкилбензолов и, возможно, моноалкилбензолов доля орто-нитрозамещенного продукта возрастает также за счет ипсо-атаки по замещенному атому углерода.
|



 -комплекс с нитрогруппой в положении 3. При повышении температуры до 0оС он перегруппировывается в более стабильный "нормальный"-
-комплекс с нитрогруппой в положении 3. При повышении температуры до 0оС он перегруппировывается в более стабильный "нормальный"-