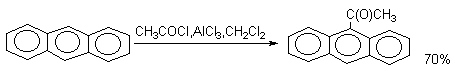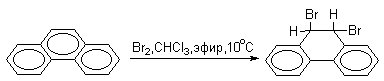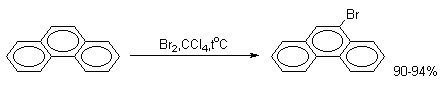Электрофильное замещение в конденсированных бензоидных ароматических системах
Электрофильное замещение в соединениях данного типа также протекает с частичным нарушением ароматической системы на стадии образования Из приведенных данных можно сделать два важных вывода:
Электрофильное замещение в нафталине приводит к одинаковой потере энергии стабилизации (на стадии образования
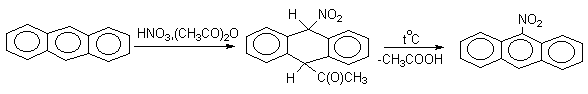
Энергетически менее выгодные резонансные структуры, в которых нарушена ароматичность обоих колец, мы не приводим, хотя полностью исключить участие второго кольца в делокализации положительного заряда в Электрофильное замещение в конденсированных системах может протекать как по классическому механизму SE(Ar) с образованием аренониевых ионов, так и по ионому механизму присоединения-отщепления. Доказано, что галогенирование и нитрование антрацена в мягких условиях протекают через промежуточное образование продуктов 9,10-присоединения, которые легко превращаются в 9-производные антрацена (при избытке электрофильного реагента образуются 9,10-дизамещенные производные антрацена.
Приведенные примеры демонстрируют "диеновый" характер антрацена и его склонность к реакциям 1,4-присоединения, характерным для сопряженных диенов. В тоже время, ацилирование антрацена проводят в условиях, типичных для процессов SE(Ar).
В фенантрене углерод-углеродная связь 9-10 проявляет свойства двойной связи в алкенах (гидрирование, озонолиз, галогенирование). Так, бромирование фенантрена при низкой температуре в растворе CCl4 приводит к преимущественному образованию продукта 9,10-присоединения.
В более жестких условиях или в присутствии кислоты Льюиса образуется только 9-бромфенантрен.
Экспериментальные данные показывают, что не всегда можно заранее предсказать результат конкретной реакции электрофильного замещения в конденсированных системах. Следует помнить, что при этом реализуются не только общие закономерности, изложенные выше, но и проявляются индивидуальные особенности каждой конденсированной системы. Например, нитрование фенантрена протекает неоднозначно и выход 9-нитрофенантрена составляет не более 35% (кроме 9-фенантрена образуются 9,10-динитрофенантрен, 1-, 2-, 3- и 4-мононитрофенантрены). Ацилирование фенантрена вообще не приводит к образованию 9-ацетилфенантрена, а протекает следующим образом:
Сульфирование для этих систем (реакция обратима) протекает еще сложнее, т.к. первоначально образующиеся продукты (продукты кинетического контроля) изомеризуются в условиях реакции в более термодинамически стабильные продукты (продукты термодинамического контроля). Более подробную информацию по электрофильному замещению в полиядерных конденсированных системах можно найти в книге Ю.С.Шабарова "Органическая химия", Москва, Химия,1994, т.2, гл.12.
|

 -комплекса. Потери энергии стабилизации в этом случае существенно ниже, чем в случае бензола или соединений с изолированными бензольными ядрами. Напомним величины энергии стабилизации (кДж/моль) для ароматических соединений, рассматриваемых в данном разделе: бензол - 150; нафталин - 255; бифенил - 300; антрацен - 350; фенантрен - 385. Потери энергии стабилизации (кДж/моль) при образовании
-комплекса. Потери энергии стабилизации в этом случае существенно ниже, чем в случае бензола или соединений с изолированными бензольными ядрами. Напомним величины энергии стабилизации (кДж/моль) для ароматических соединений, рассматриваемых в данном разделе: бензол - 150; нафталин - 255; бифенил - 300; антрацен - 350; фенантрен - 385. Потери энергии стабилизации (кДж/моль) при образовании  - положение, так и при его атаке в
- положение, так и при его атаке в  -положение нафталиновой системы. Однако, для аренониевого иона, образующегося в первом случае, можно изобразить две энергетически выгодные резонансные структуры, тогда как во втором случае - только одну.
-положение нафталиновой системы. Однако, для аренониевого иона, образующегося в первом случае, можно изобразить две энергетически выгодные резонансные структуры, тогда как во втором случае - только одну.