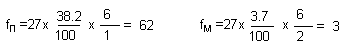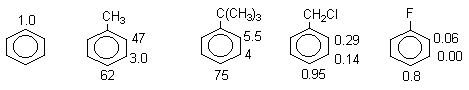Факторы парциальных скоростей. Фактор селективности.
Количественная оценка ориентирующего влияния заместителей основывается на вычислении величин так называемых факторов парциальных скоростей. Этот термин был введен К.Ингольдом в 1930-х годах. Фактор парциальной скорости - это отношение скорости реакции замещения в орто-, мета- или пара-положение молекулы С6Н5Х к скорости замещения бензола. Например, в уксусном ангидриде при 30оС толуол нитруется в 27 раз быстрее бензола и образуется 58.1% орто-нитротолуола; следовательно, фактор парциальной скорости для орто-замещения в толуоле (fo) равен 47.
В той же реакции образуется 38.2% пара-нитротолуола и 3.7% мета-нитротолуола; отсюда:
Для всех положений в толуоле факторы парциальных скоростей больше единицы, как и было предсказано на основании качественных рассуждений в предыдущем разделе (рис.4). Ниже приведены факторы парциальных скоростей fo,fm,fп для нитрования некоторых монозамещенных бензолов.
Эти данные находятся в хорошем соответствии с качественными представлениями об ориентации, согласно которым все положения в галогенбензолах дезактивированы по сравнению с бензолом, но наиболее сильно дезактивировано мета-положение. Хлорметильная группа представляет интерес в том отношении, что активирующее влияние СН3-группы погашено дезактивирующим влиянием хлора. Конечным результатом является орто-пара-ориентация при слабой общей дезактивации. Резкое понижение величины fо для трет-бутилбензола по сравнению с толуолом, несомненно, обусловлено пространственными препятствиями, создаваемыми трет-бутильной группой для орто-замещения. Таким образом, фактор fо зависит не только от электронных эффектов заместителя Х в С6Н5Х, которые влияют на все три положения в кольце (орто-, мета- и пара-положения), но и от стерических эффектов (размер заместителя Х и атакующего электрофила). Сравнение факторов парциальных скоростей для реакций электрофильного замешения в толуоле показывает, что они различны в зависимости от природы атакующего электрофила (табл.3). Менее активные электрофилы реагируют более избирательно и их селективность выше. Для количественного описания селективности электрофилов предложен еще один параметр - фактор селективности (Sf), представляющий собой логарифм отношения fп/fм для замещения в толуоле.
Этот фактор используется в тех случаях, когда можно надежно определить величину fм для толуола. Высокие значения (Sf), так же как и высокие значения fп, характерны для электрофильных агентов, проявляющих высокую селективность. Низкие значения (Sf) и fп типичны для очень реакционноспособных электрофильных агентов. В табл.3 приведены относительные скорости, факторы парциальных скоростей и факторы селективности для важнейших реакций электрофильного замещения в толуоле. Активность электрофильного агента повышается от молекулярного брома в уксусной кислоте к комплексу трет-бутилбромида с трехбромистым галлием в реакции алкилирования по Фриделю-Крафтсу. Селективность наиболее высока для электрофильных агентов, представленных в верхней части таблицы. К ним относятся молекулярный бром, хлор, ацилирующие агенты. Протонирование, нитрование, меркурирование, как правило, не отличаются высокой селективностью, а алкилирование по Фриделю-Крафтсу вообще мало селективно. При алкилировании толуола комплексом алкилгалогенида с бромистым галлием образуется 21-32% мета-изомера, тогда как при бромировании и хлорировании в уксусной кислоте доля мета-изомера не превышает 0,3%. Таблица 3 Относительные скорости реакции. Факторы парциальных скоростей fо , fм, fп и факторы селективности для важнейших реакций электрофильного замещения в толуоле (стандарт-бензол)
Данные, приведенные в таблице 3, удобно представить в виде графика зависимости величины lg fn от sf (рис.7). Как видно, наблюдается превосходная линейная корреляция этих величин для очень многих реакций электрофильного ароматического замещения в толуоле, т.е. все эти реакции являются родственными и протекают по сходному механизму. Необходимо отметить, что прямая на этом рисунке проходит через начало координат. Эта точка соответствует статистическому распределению орто-, мета- и пара-изомеров, которое не достигается ни для одного из известных в настоящее время активных электрофильных реагентов.
Рис.7. Зависимость между реакционной способностью (lg fпара) и селективностью (Sf) различных реакций замещения в толуоле Во многих случаях, особенно для реакционноспособных субстрата, содержащих сильные электронодонорные группы R2N, RO, HO, H2N и т.д. трудно получить надежные значения величин fп и fм, так как fп велико, а fм мало. С такой же проблемой приходится сталкиваться и для реакций замещения под действием слабых электрофильных агентов, где точное определение величины fм особенно затруднительно. Уже при бромировании и хлорировании толуола в уксусной кислоте доля мета-бром(хлор)толуола не превышает 0,5%. При бромировании анизола, моно- и диалкиланилинов и других реакционноспособных субстратов количество мета-изомера невозможно определить даже с помощью очень чувствительных ГЖХ. Оригинальным методом решения этой важной проблемы ориентации является изучение простейшей реакции изотопного обмена водорода в кислой среде для селективно дейтерированных или тритированных модельных соединениях.Это исключительно чувствительный метод, который позволяет оценить факторы парциальных скоростей, имеющие величину порядка 103-104. В качестве примера приведены относительные скорости для реакции протодедейтерирования (замещения дейтерия на протий) изотопно замещенных анизолов в реакции в водной HClO4:
|