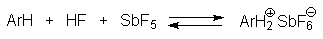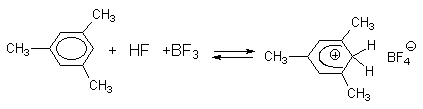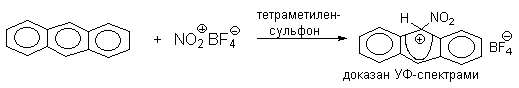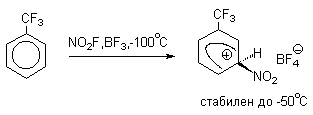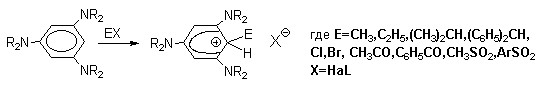Механизм присоединения-отщепления SEAr является универсальным для реакции любого ароматического субстрата с любым электрофилом, однако, в рамках единого механизма каждая конкретная реакция имеет свои характерные отличия. Эти отличия обусловлены тем фактом, что процесс SEAr включает ряд последовательных стадий, в простейшем случае две: арен  аренониевый ион и аренониевый ион
аренониевый ион и аренониевый ион  продукт замещения. Поэтому наблюдаемая скорость конкретной реакции может быть связана со скоростью разных стадий или даже со скоростями обеих стадий.
продукт замещения. Поэтому наблюдаемая скорость конкретной реакции может быть связана со скоростью разных стадий или даже со скоростями обеих стадий.
Кроме того, в результате многочисленных исследований было установлено, что кроме минимума, соответствующего аренониевым ионам, в некоторых реакциях на пути от реагентов к продуктам имеется еще ряд минимумов (потенциальных "ям"), которые соответствуют очень слабым ассоциатам субстрата с электрофилом. Такие ассоциаты получили название  -комплексов.
-комплексов.
Интермедиаты, возникающие в ходе реакции SEAr, мы рассмотрим на примере простейшей реакции - изотопного обмена в ароматических субстратах под действием различных галогеноводородных кислот, например:
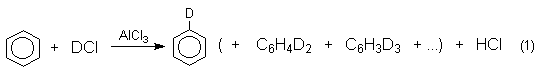
Эта реакция характеризуется минимальными структурными изменениями и обнаруженные в ней закономерности легко перенести на другие более сложные реакции электрофильного замещения.
2.2.  -Комплексы
-Комплексы
Как известно, арены являются  -основаниями и могут образовывать донорно-акцепторные комплексы со многими электрофильными реагентами.
-основаниями и могут образовывать донорно-акцепторные комплексы со многими электрофильными реагентами.
Так, при пропускании сухих газообразных HCl или DCl в раствор бензола, толуола, ксилолов или других полиалкилбензолов в н-гептане при -78оС удалось обнаружить образование молекулярных комплексов состава 1:1 (Г.Браун, 1952 г.). Эти комплексы не окрашены, их растворы в ароматических углеводородах неэлектропроводны. При растворении газообразного DCl в бензоле, толуоле, ксилолах, мезитилене, пентаметилбензоле не происходит обмен H на D, следовательно, реакция (1) не идет. Поскольку растворы комплексов не проводят электрический ток, они не являются ионными частицами, т.е. это не аренониевые ионы. Такие донорно-акцепторные комплексы получили название  -комплексов. Например, кристаллы комплексов бензола с бромом или хлором состава 1:1 согласно рентгеноструктурным данным состоят из цепочек чередующихся молекул
-комплексов. Например, кристаллы комплексов бензола с бромом или хлором состава 1:1 согласно рентгеноструктурным данным состоят из цепочек чередующихся молекул  -донора состава (C6H6) и акцептора (Cl2,Br2), в которых молекула галогена расположена перпендикулярно плоскости кольца вдоль оси, проходящей через его центр симметрии.
-донора состава (C6H6) и акцептора (Cl2,Br2), в которых молекула галогена расположена перпендикулярно плоскости кольца вдоль оси, проходящей через его центр симметрии.
Константы устойчивости  -комплексов очень слабо зависят от природы ароматического субстрата. Так, например, константы устойчивости
-комплексов очень слабо зависят от природы ароматического субстрата. Так, например, константы устойчивости  -комплексов HCl и DCl с ароматическими углеводородами при -78оС при переходе от бензола к мезитилену (1,3,5-триметилбензолу) и дуролу (1,2,4,5-тетраметилбензолу) возрастают всего в 3-4 раза. Константы устойчивости
-комплексов HCl и DCl с ароматическими углеводородами при -78оС при переходе от бензола к мезитилену (1,3,5-триметилбензолу) и дуролу (1,2,4,5-тетраметилбензолу) возрастают всего в 3-4 раза. Константы устойчивости  -комплексов йода с бензолом и гексаметилбензолом различаются не более чем в десять раз.
-комплексов йода с бензолом и гексаметилбензолом различаются не более чем в десять раз.
2.3.  -Комплексы (аренониевые ионы)
-Комплексы (аренониевые ионы)
При введении в раствор HCl и DCl в алкилбензолах AlCl3 или AlBr3 раствор начинает проводить электрический ток. Такие растворы окрашены и их окраска изменяется от желтой до оранжево-красной при переходе от пара-ксилола к пентаметилбензолу. В системах ArH-DCl-AlCl3 или ArH-DF-BF3 атомы водорода ароматического кольца уже обмениваются на дейтерий (реакция 1). Электропроводность растворов определенно указывает на образование ионов в тройной системе арен-галогенводород-галогенид алюминия. Строение таких ионов было установлено с помощью ЯМР-спектроскопии на ядрах 1Н и 13С в системе ArH-HF(жидк)-BF3 или ArH-HF-SbF5 в SO2ClF при низкой температуре. Оно полностью соответствует структуре аренониевого иона I

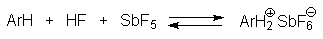
Устойчивость  -комплексов (аренониевых ионов), в отличие от устойчивости
-комплексов (аренониевых ионов), в отличие от устойчивости  -комплексов, очень сильно зависит от числа и природы заместителей в бензольном кольце. Так, бензолониевый ион С6Н7+ получен только в суперкислой среде HF-SbF5-SO2ClF при -134оС, тогда как мезитилен образует аренониевый ион при взаимодействии с HF в присутствии BF3 устойчивый до -30оС.
-комплексов, очень сильно зависит от числа и природы заместителей в бензольном кольце. Так, бензолониевый ион С6Н7+ получен только в суперкислой среде HF-SbF5-SO2ClF при -134оС, тогда как мезитилен образует аренониевый ион при взаимодействии с HF в присутствии BF3 устойчивый до -30оС.
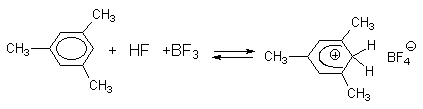
Этот  -комплекс имеет желтую окраску и полностью разлагается на исходные компоненты уже при -15оС. При использовании в качестве кислоты Льюиса SbF5 образуется соль с противоионом SbF6- , которая более стабильна и не разлагается даже при +50оС.
-комплекс имеет желтую окраску и полностью разлагается на исходные компоненты уже при -15оС. При использовании в качестве кислоты Льюиса SbF5 образуется соль с противоионом SbF6- , которая более стабильна и не разлагается даже при +50оС.
В табл.1 приведены вычисленные величины рКа аренониевых ионов, характеризующие основность аренов в системе жидкий HF/BF3. Термодинамическая устойчивость  -комплексов ароматических соединений с протоном изменяется в том же порядке, что и их основность.
-комплексов ароматических соединений с протоном изменяется в том же порядке, что и их основность.
Таблица 1
Кислотность аренониевых ионов в жидком HF при 0оС, характеризующая стабильность протонных  -комплексов
-комплексов
1. Бензол и метилбензолы
| Углеводород
| рКа (ArH2+)
| Углеводород
| рКа (ArH2+)
|
| Бензол
| -9.2
| 1,3,5-триметилбензол
| -0.4
|
| толуол
| -6.3
| 1,2,3,4-тетраметилбензол
| -1.9
|
| 1,2-диметилбензол
| -5.3
| 1,2,3,5-тетраметилбензол
| +0.1
|
| 1,3-диметилбензол
| -3.2
| 1,2,4,5-тетраметилбензол
| -2.2
|
| 1,4-диметилбензол
| -5.7
| пентаметилбензол
| +0.4
|
| 1,2,3-триметилбензол
| -2.8
| гексаметилбензол
| +1.4
|
| 1,2,4-триметилбензол
| -2.9
|
|
|
Полиядерные ароматические углеводороды
| Название
| Структура
| рКа (ArH2+)
|
| бифенил
| 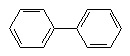
| -5.5
|
| нафталин
| 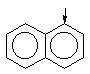
| -4.0
|
| антрацен
| 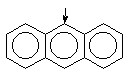
| +3.8
|
| 9-метилантрацен
| 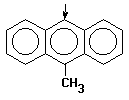
| +5.7
|
Из данных табл. 1 можно сделать следующие выводы:
- Введение метильных групп в бензольное кольцо увеличивает основность арена. Причем, введение второй метильной группы в мета-положение к первой (1,3-диметилбензол или м-ксилол) увеличивает основность арена в гораздо большей степени, чем ее введение в орто- или пара-положение к уже имеющейся метильной группе (1,2-и 1,4-диметилбензолы или орто- и пара-ксилолы). Это обусловлено тем, что в орто- и пара-диметилбензолах лишь одна из метильных групп может находиться в орто- или пара-положении к возникающему в
 -комплексе геминальному узлу, т.е. лишь одна из групп СН3 эффективно стабилизирует положительный заряд (распределенный в орто- и пара-положениях к геминальному узлу
-комплексе геминальному узлу, т.е. лишь одна из групп СН3 эффективно стабилизирует положительный заряд (распределенный в орто- и пара-положениях к геминальному узлу  -комплекса).
-комплекса). - Конденсированные ароматические системы более основны, чем бензол. Это связано с уменьшением их ароматического характера.
Подобного рода  -комплексы были зафиксированы при низкой температуре для многих реакций электрофильного замещения в ароматическом кольце. Ниже приводятся некоторые наиболее типичные примеры.
-комплексы были зафиксированы при низкой температуре для многих реакций электрофильного замещения в ароматическом кольце. Ниже приводятся некоторые наиболее типичные примеры.

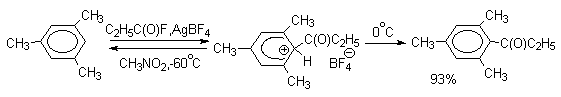
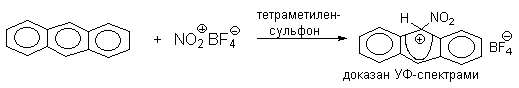
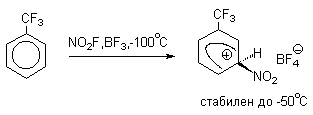
Стабильные при комнатной температуре бензолониевые ионы получены в случае 1,3,5-трис(диалкиламино)бензолов:
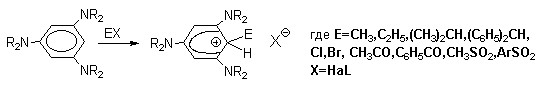
Таким образом, устойчивость  - комплексов должна быть большей при наличии в ароматическом ядре электронодонорных заместителей, участвующих в делокализации положительного заряда, а также при наличии комплексных противоионов типа BF4- или SbF6- (слабые основания).
- комплексов должна быть большей при наличии в ароматическом ядре электронодонорных заместителей, участвующих в делокализации положительного заряда, а также при наличии комплексных противоионов типа BF4- или SbF6- (слабые основания).

 аренониевый ион и аренониевый ион
аренониевый ион и аренониевый ион  -комплексов.
-комплексов.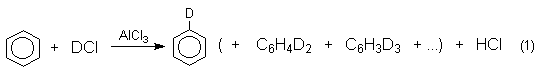
 -Комплексы (аренониевые ионы)
-Комплексы (аренониевые ионы)