Примеры решения задач. Пример 1. Элемент образует гидрид, где его массовая доля 75%
Пример 1. Элемент образует гидрид, где его массовая доля 75%. Определите эквивалентную массу элемента. Решение. Эквивалентом элемента называется такое его количество, которое соединяется с одним молем атомов водорода или замещает его в химических реакциях. Массу одного моля эквивалента элемента называют молярной массой эквивалента. Эта задача решается на основе закона эквивалентов, согласно которому химические элементы (сложные вещества) соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов. Вычислим массовую долю водорода в гидриде w (Э) = 100% - 75% = 25%. Согласно закону эквивалентов m(Эл) / m(H) =MЭ(Эл) / MЭ(H). При образовании 100 г гидрида 25 г водорода соединяются с 75 г элемента. Исходя из этого MЭ(Эл) = 1 г/моль ´ 75 г / 25 г = 3 г/моль. Пример 2. При сгорании 15 г металла образуется 28,32 г оксида металла. Вычислите эквивалентную массу металла. Решение. Эквивалентная масса кислорода MЭ (О) = 8 г/моль. Масса кислорода в оксиде m (O) = 28,32 - 15,00 = 13,32 г. Тогда согласно закону эквивалентов: MЭ(Ме) = МЭ(О) ´ m(Me) / m (O) = 8 г/моль ´ 15 г / 13,32 г = 9 г/моль. Пример 3. Рассчитайте молярную массу эквивалента металла, если 1,168 г его вытеснили из кислоты 438 мл водорода, измеренного при 17оС и давлении 98642 Па. Решение. Приведем объем вытесненного водорода к нормальным условиям, воспользовавшись объединенным газовым уравнением
V0 = P ´ V ´ Т0 / P0 ´ Т = 98642 ´ 438 ´ 273 / 1,013 ´ 10 5 ´ 298 = 401,5 мл. Эквивалентный объем водорода VЭ (H2) = 11,2 л/моль при нормальных условиях, поэтому m(Me) / V (H2) = MЭ (Ме) / VЭ (H2); MЭ (Me) = 1,168 г ´ 11,2 л/моль / 0,4015 л = 32,58 г/моль.
Пример 4. На нейтрализацию 0,471 г фосфористой кислоты израсходовано 0,644 г KOH. Вычислите молярную массу эквивалента кислоты. Решение. Эквивалентная масса КОН равна ее молярной массе, так как основание содержит одну гидроксогруппу и составит MЭ (КОН) =56 г/моль. Тогда согласно закону эквивалентов: m (кислоты) / m (КОН) = MЭ (кислоты) / MЭ (КОН); MЭ (кислоты) = 56 г/моль ´ 0,471 г / 0, 644 г = 40, 96 г/моль.
|

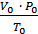 =
= 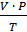 ,
,


