|
| Уровень воды в бюретке до проведения реакции V1, мл
|
|
|
| Уровень воды в бюретке после проведения опыта V2, мл
|
|
|
| Объём выделившегося водорода 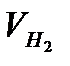 , мл , мл
|
|
|
| Объём водорода при нормальных условиях V0 (H2), мл
|
|
|
| Масса магния mMg, г
|
|
|
| Температура опыта t°, 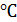
|
|
|
| Абсолютная температура, °K
|
|
|
| Атмосферное давление Pатм, мм рт. ст. (кПа)
|
|
|
| Парциальное давление насыщенных водяных паров при температуре опыта 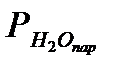 , мм рт. ст. (кПа) , мм рт. ст. (кПа)
|
|
|
| Парциальное давление водорода 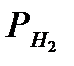 , мм рт. ст. (кПа) , мм рт. ст. (кПа)
|
|
|
| Эквивалент магния, рассчитанный по табличной атомной массе (Мэ (Мg) теор. )
|
|
|
| Эквивалент магния, рассчитанный по данным опыта (Мэ (Мg)оп)
|
|
|
| Относительная ошибка определения (Аотнос .).
|
|
а) найденный объем водорода 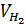 необходимо привести к нормальным условиям. Нужно вычислить
необходимо привести к нормальным условиям. Нужно вычислить 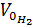 с точностью до 0,1. При этом надо учесть, что водород, собранный над водой, содержит водяной пар, давление газа в бюретке, равное атмосферному, складывается из парциальных давлений водорода
с точностью до 0,1. При этом надо учесть, что водород, собранный над водой, содержит водяной пар, давление газа в бюретке, равное атмосферному, складывается из парциальных давлений водорода 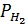 и паров воды
и паров воды 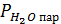 .
.
Ратм = 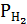 +
+ 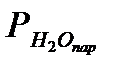 , откуда
, откуда 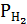 = Ратм -
= Ратм - 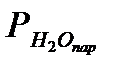 .
.
Приведение газа к нормальным условиям производится на основании уравнения состояния идеального газа, объединяющего законы Бойля - Мариотта и Гей - Люссака:
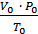 =
= 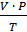 , откуда
, откуда 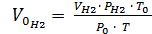 ,
,
где Р0 – нормальное давление, мм рт. ст.;
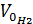 – объем водорода при нормальных условиях, мл;
– объем водорода при нормальных условиях, мл;
Т0 – 273 K (т.е. по абсолютной шкале температур);
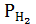 – парциальное давление сухого водорода, равное измеренному атмосферному давлению Ратм за вычетом парциального давления водяных паров при температуре опыта;
– парциальное давление сухого водорода, равное измеренному атмосферному давлению Ратм за вычетом парциального давления водяных паров при температуре опыта;
б) вычислить эквивалент металла, зная массу металла и объем вытесненного водорода:
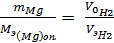 , откуда Мэ (Мg) =
, откуда Мэ (Мg) =  ;
;
в) вычислить теоретический эквивалент (эквивалентную массу) металла;
г) сравнить эквивалент металла, полученный опытным путем, с теоретическим и найти относительную ошибку опыта с точностью до 0,1 % по формуле:
Аотносит. = 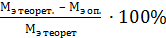 .
.

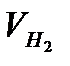 , мл
, мл
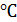
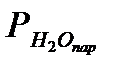 , мм рт. ст. (кПа)
, мм рт. ст. (кПа)
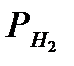 , мм рт. ст. (кПа)
, мм рт. ст. (кПа)
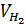 необходимо привести к нормальным условиям. Нужно вычислить
необходимо привести к нормальным условиям. Нужно вычислить 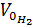 с точностью до 0,1. При этом надо учесть, что водород, собранный над водой, содержит водяной пар, давление газа в бюретке, равное атмосферному, складывается из парциальных давлений водорода
с точностью до 0,1. При этом надо учесть, что водород, собранный над водой, содержит водяной пар, давление газа в бюретке, равное атмосферному, складывается из парциальных давлений водорода 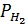 и паров воды
и паров воды 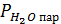 .
.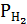 +
+ 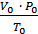 =
= 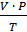 , откуда
, откуда 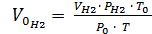 ,
,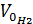 – объем водорода при нормальных условиях, мл;
– объем водорода при нормальных условиях, мл;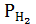 – парциальное давление сухого водорода, равное измеренному атмосферному давлению Ратм за вычетом парциального давления водяных паров при температуре опыта;
– парциальное давление сухого водорода, равное измеренному атмосферному давлению Ратм за вычетом парциального давления водяных паров при температуре опыта;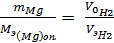 , откуда Мэ (Мg) =
, откуда Мэ (Мg) =  ;
;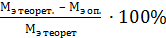 .
.


