Закон эквивалентов (Рихтер, 1792 г.)
Химические элементы (сложные соединения) соединяются или замещают друг друга в весовом соотношении, равном отношению их эквивалентных масс
где m1 и m2 – массы реагирующих веществ (г, кг, %). Если одно из веществ находится в газообразном состоянии, закон эквивалентов записывается следующим образом:
где m1 и Мэ1 – масса и эквивалентная масса твердого или жидкого вещества; V2 и Vэ2 – объем и молярный объем эквивалента газообразного вещества; Vэ – молярный объем эквивалента газа (эквивалентный объем) при нормальных условиях. Как известно, моль любого газа при нормальных условиях занимает объем 22,4 л. Так как масса моля водорода равна 2 г, а масса эквивалента – 1 г, то эквивалентный объем водорода будет в два раза меньше молярного, т.е. Vэ (Н) = 22,4: 2 = 11,2 л/экв. Молярная масса кислорода 32 г/ моль соответствует объему 22,4 л. Т.к. эквивалентная масса кислорода – 8 г/экв, то его эквивалентный объем Vэ (О) = 22,4: 4 = 5,6 л/экв; Vэ =
|

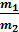 =
= 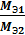 или
или 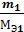 =
= 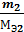 ,
,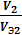 ,
, 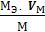 .
.


