Методы получения монокарбоновых кислот
1.3.1. Реакция окисления. В большинстве случаев происходит расщепление молекулы, и получающиеся кислоты содержат в молекуле меньше атомов углерода, чем исходное окисляемое вещество:
cоли Са, Mn ОН ОН
ОН ОН ОН
При окислении первичных спиртов и альдегидов получаются кислоты с тем же числом атомов в молекуле:
ОН
Н ОН 1.3.2. Реакция гидролиза
ОН- или Н+ ОН
ОН- или Н+ ОН
ОН- или Н+ ОН
NН2 Н+ ОН
1.3.3.Металлоорганический синтез: используют, например, реактивы Гриньяра R – MgX, где Х – галоген (Br, J).
OMgX OH
1.3.4. Реакция карбоксилирования: идет при давлении (Р), равном от 0,1 до 20 мПа, t = 100-2000 С, катализатор – карбонил кобальта НСо (СО)4
Н2О ОН
где Х = ОН-; OR-; OOCR-.
Н2О ОН 1.3.5. Декарбоксилирование двух- и трехосновных кислот, содержащих карбоксилы при одном атоме углерода:
СООН ОН малоновая кислота уксусная кислота
СООН ОН щавелевая кислота муравьиная кислота
1.3.6. Обмен заместителей в молекулах насыщенных кислот:
хлоруксусная ОН кислота
|

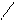


 О О
О О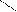
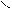 СН3 – СН2 – СН3
СН3 – СН2 – СН3 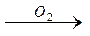 СН3 – С + Н – С
СН3 – С + Н – С

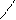

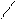
 О О О О
О О О О


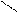
 СН3 –СН2 –С–СН3
СН3 –СН2 –С–СН3 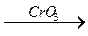 СН3–СН2 –С + Н – С + СН3 – С
СН3–СН2 –С + Н – С + СН3 – С
 О
О R – СН2 – ОН
R – СН2 – ОН 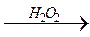 R – С
R – С 

 О О
О О
 R – С
R – С 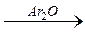 R – С
R – С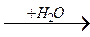 R – С
R – С 

 R – С
R – С 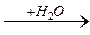 R – С + NH3
R – С + NH3
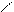


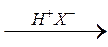 O O
O O
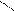 R – MgX + CО2 → R – C R – C + Mg X2.
R – MgX + CО2 → R – C R – C + Mg X2.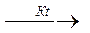 R – С
R – С 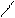
 О
О R – CН = СН2+ СО
R – CН = СН2+ СО  СН3 - С + СО2 или
СН3 - С + СО2 или

 О
О СН2Сl – СООН + 2 [Н] → СН3 – С + НСl.
СН2Сl – СООН + 2 [Н] → СН3 – С + НСl.


