Химические свойства монокарбоновых кислот
1.4.1. Кислотные свойства:
ОН О-
Ö:- Наиболее сильной из карбоновых кислот является муравьиная (кислота средней силы). 1.4.2. Взаимодействие с металлами, основными и амфотерными оксидами и гидроксидами. Реагируют подобно неорганическим кислотам с образованием солей. Соли муравьиной кислоты называются формиаты; уксусной – ацетаты; пропионовой – пропионаты; масляной кислоты – бутираты; валериановой кислоты – валеринаты. 1.4.3. Декарбоксилирование: используют либо электролиз монокарбоновых кислот и их солей, либо сплавление солей этих кислот со щелочами
ОNa
ОNa 1.4.4. Гидролиз кислот и их солей:
ОН Al2O3 кетон
ОН 1.4.5. Получение галогенангидридов кислот:
ОН Cl
1.4.6. Действие окислителей. Окислители с трудом реагируют с жирными кислотами, причем под их действием происходит разрушение молекулы кислоты. Однако разбавленная Н2О2 медленно окисляет жирные кислоты с образованием сначала оксикислот, затем кетонокислот. Последние, как правило, неустойчивы и тут же декарбоксилируются.
OH
OH 1.4.7. Восстановление:
ОH ONa
ОH 1.4.8. Образование амидов и нитрилов. Аммиак и его производные при взаимодействии с карбоновыми кислотами образуют аммониевые карбоксилаты. Но при повышении t0 происходит присоединение к карбонильной группе и получаются амиды.
ОH NHR’ При дальнейшем нагревании с водоотнимающими средствами (Р2О5) получается нитрил кислоты:
NH2 Р2О5
1.4.9. Образование сложных эфиров: О
ОH 1.4.10. Реакции замещения водорода у α – углеродного атома. Водород у α – углеродного атома может замещаться на галоген (кроме йода).
ОН электролиз F
ОН t0, hυ OH t0, hυ OH
t0, hυ OH
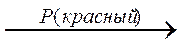    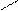 О α O О α O
ОH +Br2 Br. Br
|

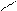
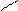
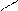
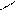 О О
О О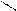
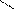 R – С + НОН ↔ R – С + Н3О+
R – С + НОН ↔ R – С + Н3О+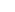 Карбоксилат – ион построен симметрично и имеет систему сопряженных связей:
Карбоксилат – ион построен симметрично и имеет систему сопряженных связей:
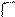


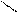 R – С
R – С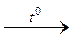
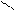 R – СH2 – C + NaОН R – СН3 + Na2CO3.
R – СH2 – C + NaОН R – СН3 + Na2CO3.

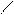
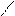
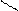 R – С О
R – С О

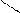 О
О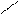 Са R – С – R + СаСО3.
Са R – С – R + СаСО3. О
О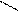 R – C
R – C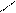
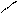
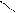
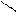 R – C + PCl5 → R – С + POCl3 + HCl.
R – C + PCl5 → R – С + POCl3 + HCl.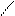
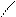
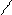
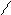 O O
O O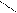
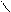 R – CH2– CH2– CH2– C
R – CH2– CH2– CH2– C 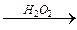 R – CH2– CH– CH2– C →
R – CH2– CH– CH2– C → OH H2O OH
OH H2O OH

 O O
O O
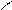
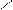 O
O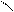 → R – CH2– C – CH2 – C → R – CH2 – C– CH3 + CO2.
→ R – CH2– C – CH2 – C → R – CH2 – C– CH3 + CO2.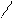
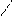

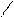 О O
О O
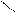 R – C + NaBH4 → R – С + H2 + BH3
R – C + NaBH4 → R – С + H2 + BH3 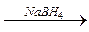 R – CH2 – OH;
R – CH2 – OH;
 О
О R – C + 6HJ → R – СH3 + 3J2 +2H2O.
R – C + 6HJ → R – СH3 + 3J2 +2H2O.
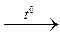



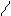
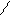
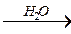
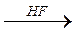
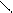
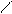
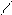
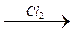
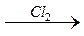
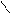
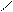
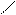
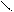 Cl3C – C;
Cl3C – C;
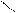
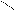 R – CH2 – C R – CH – C
R – CH2 – C R – CH – C


