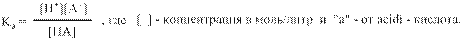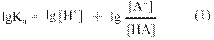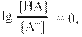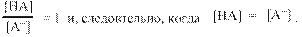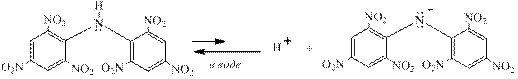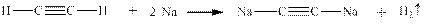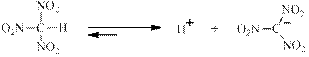Классификация кислот по силе
По силе кислоты подразделяют на сильные кислоты, кислоты средней силы, слабые кислоты и некоторые авторы выделяют еще и очень слабые кислоты. Мерой силы кислот является величина – рКа. Вывод формулы рКа. Любая кислота способна к диссоциации на ионы НА
Если прологарифмировать это выражение, используя десятичные логарифмы, то получается уравнение (1):
Если поменять знаки на противоположные и использовать свойства логарифмов получаем уравнение (2):
Принято величину – lgKa обозначать, как рКа, а величину – lg[H+], как рН. В результате уравнение (2) преобразовывается в уравнение (3):
Из уравнения (3) следует, что рKа = рН в том случае, когда
а это в свою очередь возможно, если
Таким образом рКа это то значение рH среды, при котором концентрация недиссоциированной кислоты равна концентрации её аниона или, иными словами, когда кислота диссоцирована наполовину. Для каждой кислоты можно определить значение рКа. Если значение рКа отрицательно, то кислота сильная, если значение рКа положительно, но меньше 3,5, то кислота средней силы, а если больше 3,5, то кислота слабая. Знание рКа позволяет легко предсказать, будет ли данная кислота вытеснять другую кислоту из ее соли. Математический расчет показывает, что кислота, имеющая рКа меньше на единицу, вытесняет другую кислоту из ее соли на 90%, например:
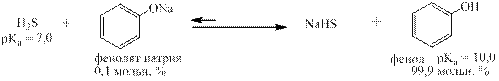
Если рКа вытесняющей кислоты меньше рКа вытесняемой на 2 единицы рН или больше, то происходит вытеснение кислоты на 99% или более. Например:
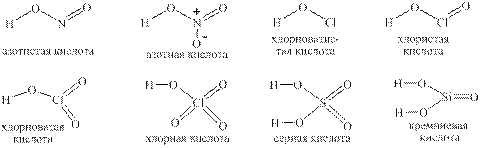
Любая сильная кислота вытеснит любую слабую кислоту из ее соли практически нацело. По типу разрываемой связи с атомом «Н» По этому типу кислоты подразделяют на элемент(Э) − Н, О − Н, N – H, C – H и S − H кислотам. К Э – Н относят, например: HF, HCl, HBr, HI, H2Se, H2Te. О − Н – кислоты. В О − Н кислотах водород отрывается при диссоциации от кислорода, хотя в этих кислотах в подавляющем большинстве случаев содержатся и другие атомы, например:
В некоторых О – Н кислотах имеются атомы водорода, соединенный не с кислородом, но они, как правило, и не способны к диссоциации, например:
Фосфиновая кислота является одноосновной О – Н кислотой. Атомы водорода, связанные с фосфором не способны к диссоциации и не замещаются на металл, даже при большом избытке концентрированной щелочи. Фосфоновая кислота является двухосновной О – Н кислотой, а атом водорода связанный с фосфором также не способен диссоциации и замене на металл. N – H кислоты. К ним относится аммиак, первичные и вторичные амины. Например, в аммиаке можно заменить атом водорода, связанный с азотом, на натрий:
Еще легче реагирует с металлами ацетанилид или анилид уксусной кислоты:
2, 4, 6, 2’, 4’, 6’ – гексанитродифениламин просто диссоциирует в воде так как его рКа = 5,4 и он кислота не многим более слабая, чем уксусная:
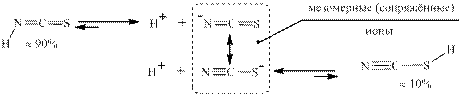
Имеется также кислота, которая является одновременно N – H и S – H кислотой. Это тиоциановая кислота:
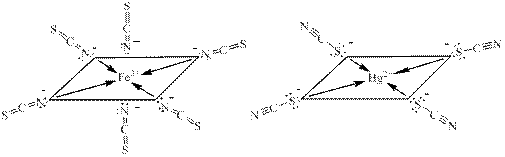
Соли этой кислоты называются тиоцианатами или роданидами: KNCS - роданид калия. Остатки этой кислоты в разных комплексных соединениях координируются к центральным атомам либо своим атомом азота, либо атомом серы. Например, анион −NCS в гексароданоферрате (III) калия - K3[Fe(NCS)6] координирован атомом азота к катиону железа (III), а в тетрароданмеркуриате (II) калия - K2[Hg(NCS)4] атомом серы к катиону ртути (II):
S – H - кислоты К S – H - кислотам относится сероводород, который является двухосновной S – H - кислотой: H2S К S – H - кислотам относится так же бесконечно большое число меркаптанов – соединений с общей формулой R – S – H, где R – углероводородный радикал, например: этилмеркаптан, тиофенол (или фенилмеркаптан) и 2-фурилмеркаптан (2-меркаптофуран).
Тиофенол имеет рКа = 9,43, то есть примерно в 6 раз более сильная кислота, чем фенол (рКа = 10) С – H - кислоты К С – H - кислотам относится ацетилен, в котором оба атома водорода можно заменить на щелочной металл, например на натрий. Ацетилен – слабая кислота, его рКа = 22.
Ним относится так же бесконечно большое количество терминальных алкинов, в которых атом водорода соединенный с атомом углерода при тройной связи, можно заменить либо на Na, либо действием реактива Толленса на серебро: CH3 – C ≡ C – H + [Ag(NH3)2]OH → CH3 – C ≡ C – Ag↓ + H2O + 2 NH3 (R) (R) Наиболее сильной, из известных С – Н кислот является тринитрометан, который практически полностью диссоциирует в воде на ионы, так – как его рКа = 0,16, то есть он является кислотой средней силы, но очень близок к сильным кислотам.
|

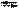 Н+ + А−. Для любого равновесного процесса можно написать уравнение для константы равновесия:
Н+ + А−. Для любого равновесного процесса можно написать уравнение для константы равновесия: