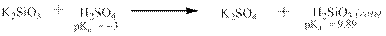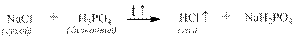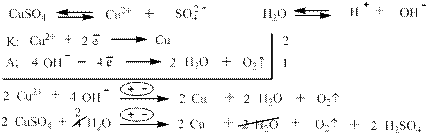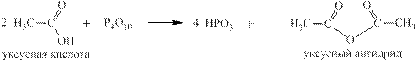Способы получения кислот
Некоторые кислоты могут быть получены прямым взаимодействием простых веществ: H2 + F2 → 2 HF жидкая плавиковая кислота (фтороводородная) 2000оС H2 + 2 С + N2 ―—→ 2 HCN синильная кислота Кислоты являющиеся растворами кислых газов в воде можно получать в две технологические стадии: 1) взаимодействие водорода с простым веществом; 2) растворение этого кислого газа в воде, например:
Так же получаюся сернистая и угольная кислоты: S + O2 → SO2 SO2 + H2O Очень многие кислоты можно получить путём взаимодействия кислотных оксидов с водой. Часть реакций обратима (с СО2 и SO2) другие не обратимы: SO3 + H2O → H2SO4, N2O5 + H2O → 2 HNO3, Cl2O7 + H2O → 2 HClO4. При взаимодействии некоторых кислотных оксидов с водой в зависимости от условий протекания реакции, могут получаться разные кислоты, например:
При взаимодействии некоторых кислотных оксидов с водой в результате реакции диспропорционирования образуются две разные кислоты:
Кислоты могут быть получены путём вытеснения их из солей более сильными кислотами:
Из солей более сильных, но летучих кислот можно их выделить под действием более слабых, но не летучих кислот:
Если кислота при комнатной температуре не является летучей, но у нее не слишком высокая температура кипения, то её можно выделить при нагревании:
Кислоты могут быть получены в результате электролиза солей, у которых катион разряжается на катоде, а анион на аноде разряжаться не может:
Кислоты могут быть получены путем обменных реакций кислот с кислотными оксидами: 4 HClO4 + P4O10 → 4 HPO4 + 2 Cl2O7 4 HNO3 + P4O10 → 4 HPO3 + 2 N2O5 В эти же реакции вступают и органические кислоты, образуя ангидриды карбоновых кислот:
Некоторые кислоты могут быть получены путём доокисления других кислот кислородом воздуха: 2 H2SO3 + O2 → 2 H2SO4 2 HNO2 + O2 → 2 HNO3 Некоторые путём доокисления оксидов в водном растворе кислородом воздуха, например, при промышленном способе получения азотной кислоты: 4 NO2 + 2 Н2О + O2 → 4 HNO3 Некоторые кислоты получаются путем диспропорционирования других кислот:
Некоторые кислоты, например, серная и ортофосфорная могут быть превращены в другие кислоты взаимодействием с соответствующими оксидами: H2SO4 + SO3 → H2S2O7 (дисерная) H2S2O7 + SO3 → H2S3O10 (трисерная) H2S3O10 + SO3 → H2S4O13 (тетрасерная) 8 H3PO4 + P4O10 → 6 H4P2O7 (пирофосфорная)
При окислении неметаллов кислотами-окислителями: As + 5 HNO3 → H3AsO4 + 5 NO2 + H2O Комплексные кислоты могут получены путём окисления благородных металлов «царской водкой»: 3 Pt + 18 HCl конц + 4 HNO3 конц. → 3 H2[PtCl6] + 4 NO↑ + 8 H2O
Au + HNO3 конц + 4 HCl конц. → H[AuCl4] + NO↑ + 2 H2O
Или окисления кремния смесью плавиковой и азотной кислот: 3 Si + 18 HF + 4 HNO3 → 3 H2[SiF6] + 4 NO + 8 H2O Органические кислоты можно получать путём окисления в разных условиях очень многих классов органических соединений, в частности алканов, алкенов, алкадиенов, алкинов, алкиларенов, первичных спиртов, альдегидов, кетонов, сложных эфиров. Монокарбоновые кислоты можно получать из дикарбоновых кислот путём их декарбоксилирования (материал будет изложен в соответствующих разделах органической химии).
|


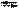 H2SO3 C + O2 → CO2 CO2 + H2O
H2SO3 C + O2 → CO2 CO2 + H2O