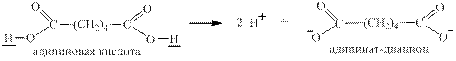Двухосновные кислоты
К двухосновным кислотам прежде всего относятся такие, в молекулах которых содержится два атома водорода и оба они способны к диссоциации, которая проходит ступенчато: H2S, H2Se, H2Te, H2C2O4, H2SO3, H2SO4, H2SiO3, H2CO3, H2CrO4, H2Cr2O7. Названия этих кислот соответственно: сероводородная, селеноводородная, теллуроводородная, щавелевая, сернистая, серная, кремниевая, угольная, хромовая, дихромовая. Пример диссоциации двуосновной кислоты: H2S Примеры взаимодействия со щёлочью H2S + KOH → KHS + H2O H2S + 2 KOH → K2S + 2 H2O Имеются также кислоты, у которых атомов водорода больше двух, но способны к диссоциации только два из них, например:
В малоновой, янтарной, адипиновой и фталевой кислотах из имеющихся в их молекулах атомов водорода замещаются в водных растворах на металл или диссоциируют только два подчёркнутых:
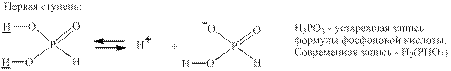
Трёхосновные кислоты Это кислоты, содержащие три атома водорода, которые все способны к диссоциации. Например, в ортофосфорной кислоте: Н3РО4 Трём ступеням диссоциации соответствуют две кислые и одна средняя соли: NaH2PO4 – дигидроортофосфат натрия – кислая соль; Na2HPO4 – гидроортофосфат натрия – кислая соль; Na3PO4 – ортофосфат натрия – средняя соль. Для сравнения: Na2(PHO3) – динатровая соль фосфоновой кислоты – средняя соль.
|

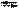 Н+ + HS− первая ступень; HS-
Н+ + HS− первая ступень; HS-