Белки: состав, синтез, структуры, функции.
Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс. Функции: 1)Катализаторы химических реакций, протекающих в организме -ферменты 2)Защита организма-антитела и токсины 3)Структурная функция- входят в состав органоидов клетки и межклеточного вещества. 4)Регуляторная- гормоны и их рецепторы 5)Обеспечивают транспорт различных веществ(белки крови) и через мембраны клеток. Молекулы белков представляют собой линейные полимеры, состоящие из остатков α-L-аминокислот (которые являются мономерами), также в состав белков могут входить модифицированные аминокислотные остатки и компоненты неаминокислотной природы. Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки из 5 аминокислотных остатков оно составляет уже более 3 миллионов, а цепочка из 100 аминокислотных остатков (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно. При образовании белка в результате взаимодействия α-карбоксильной группы (-COOH) одной аминокислоты с α-аминогруппой (-NH2) другой аминокислоты образуются пептидные связи. Концы белка называют N- и C-концом, в зависимости от того, какая из групп концевого аминокислотного остатка свободна: -NH2 или -COOH, соответственно. При синтезе белка на рибосоме первым (N-концевым) аминокислотным остатком обычно является остаток метионина, а последующие остатки присоединяются к C-концу предыдущего. Белки состоят из аминокислот, соединенных между собой в длинные цепочки. Аминокислоты, содержащиеся в белках, делят на заменимые и незаменимые. Первые могут быть синтезированы в организме из других аминокислот, имеющихся в составе пищи; вторые синтезироваться организмом не могут. Незаменимых аминокислот восемь - метионин, триптофан, лизин, лейцин, фенилаланин, изолейцин, валин, треонин - наиболее дефицитными являются первые три. Биосинтез белка — сложный многостадийный процесс синтеза полипептидной цепи изаминокислот, происходящий на рибасомах с участием молекул иРНК и тРНК. Процесс биосинтеза белка требует значительных затрат энергии. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков: α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[25] (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Хотя α-спираль может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина,серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали; • β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,34 нм на аминокислотный остаток[26]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин; • π-спирали; • 310-спирали; • неупорядоченные фрагменты. Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которыхгидрофобные взаимодействия играют важнейшую роль. Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Биосинтез белка происходит в два этапа. В первый этап входит транскрипция и процессинг РНК, второй этап включает трансляцию. Во время транскрипции фермент РНК-полимераза синтезирует молекулу РНК, комплементарную последовательности соответствующего гена (участка ДНК). Терминатор в последовательности нуклеотидов ДНК определяет, в какой момент транскрипция прекратится. В ходе ряда последовательных стадий процессинга из иРНК удаляются некоторые фрагменты, и редко происходит редактирование нуклеотидных последовательностей. После синтеза РНК на матрице ДНК происходит транспортировка молекул РНК в цитоплазму. В процессе трансляции информация, записанная в последовательности нуклеотидов, переводится в последовательность остатков аминокислот. 6. Репликация ДНК. Основные этапы и механизмы. ДНК - дезоксирибонуклеиновая кислота состоит из 2х спирально закругленных цепей, которые по всей длине соединены друг с другом водородными связями – двойная спираль. ДНК - дезоксирибонуклеиновая кислота состоит из 2х спирально закругленных цепей, которые по всей длине соединены друг с другом водородными связями – двойная спираль. ДНК представляет собой спираль, состоящую из двух комплементарных полинуклеотидных цепей, закрученных вправо. В состав нуклеотидов ДНК входят: · азотистое основание · дезоксирибоза · остаток фосфорной кислоты.
Азотистые основания делят на 1. пуриновые (аденин и гуанин) 2. пиримидиновые (тимин и цитозин).
Репликация проходит в три этапа: 1. инициация репликации 2. элонгация 3. терминация репликации.
Две цепи нуклеотидов соединяются между собой через азотистые основания по принципу комплементарности: между аденином и тимином возникают две водородные связи, между гуанином и цитозином – три.
Нуклеотиды, входящие в состав ДНК, содержат дезоксирибозу, остаток фосфорной кислоты и одно из 4х аминокислотных оснований. Каждая цепь ДНК – полинуклеотид, состоящий из множества нуклеотидов, последовательно соединенных за счет образования ковалентной связи между дезоксирибозой и остатком фосфорной кислоты разных нуклеотидов. Азотистые основания одной цепи образуют водородные связи с азотистыми основаниями другой в строгом порядке: против АДЕНИНßà ТИМИН, ГУАНИН ßà ЦИТОЗИН. Такой принцип строгого соответствия аминокислот называется принципом комплементарности.
Репликация ДНК - самоудвоение ДНК. В новообразованной цепи последовательность нуклеотидов определяется их последовательностью в первичной ДНК. Одна цепь принадлежит материнской молекуле, другая синтезируется. ДНК-полимераза катализирует синтез новых цепей. Репликация начинается одновременно на многих участках ДНК, а потом участки ДНК собираются в единое целое. Транскри́пция (от лат. transcriptio — переписывание) — процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК. Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой. Процесс синтеза РНК протекает в направлении от 5'- к 3'- концу, то есть по матричной цепи ДНК РНК-полимераза движется в направлении 3'->5'[1] Транскрипция состоит из стадий инициации, элонгации и терминации. Единицей транскрипции является транскриптон, фрагмент молекулы ДНК, состоящий из промотора, транскрибируемой части и терминатора. Трансляция (от лат. translatio — перевод) процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой.
7. Функциональная структура гена. Интроны и экзоны.
Ген (греч. genos род, происхождение) - структурно-функциональная единица генетического материала, наследственный фактор, который можно условно представить как отрезок молекулы ДНК (у некоторых вирусов - молекулы РНК), включающий нуклеотидную последовательность, в которой закодирована первичная структура полипептида (белка) либо молекулы транспортной или рибосомной РНК, синтез которых контролируется этим геном. Обусловливая первичную структуру конкретного белка, ген тем самым определяет формирование отдельного признака организма или клетки.
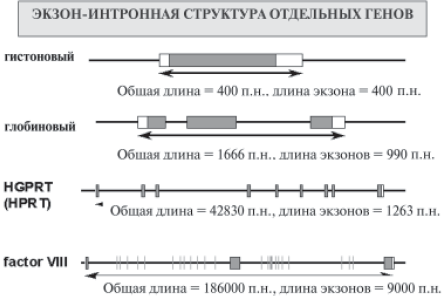
Ген представляет собой последовательность нуклеотидов ДНК размером от нескольких сотен до миллиона пар нуклеотидов, в которых закодирована генетическая информация о первичной структуре белка (число и последовательность аминокислот). Для регулярного правильного считывания информации в гене должны присутствовать: кодон инициации, множество смысловых кодонов и кодон терминации. Три подряд расположенных нуклеотида представляют собой кодон, который и определяет, какая аминокислота будет располагаться в данной позиции в белке. Ген состоит из интронов и экзонов, которые в свою очередь делятся на участки, кодирующие белок и специальные участки, кодирующие иРНК. РНК синтезируется лишь на 25% генома, белок-кодирующие последовательности это лишь 1.5%. А что же остальное? Молчащая («мусорная») ДНК составляющая более 70%. Это все мыслимые повторы (50% сателлитная ДНК), палиндромы, и бессмысленные сочетания нуклеотидов По результатам проекта «Геном человека», в 17 тыс. исследованных транскриптов у этого вида среднее число экзонов на транскрипт составило 7,8 [Venter et al., 2001]. Летальное исследование экзонов у 10 наиболее изученных модельных объектов показало, что у эукариот в среднем один ген содержит 3,7 интрона на 1 тпн кодирующего участка ДНК. Длина интрона может быть разной — от нескольких десятков пар нуклеотидов до многих тысяч (рис. 7.60). Общая длина всех интронов часто значительно превышает суммарную длину экзонов.
Свойства: 1. дискретность - несмешиваемость генов; 2. стабильность - способность сохранять структуру; 3. лабильность - способность многократно мутировать; 4. множественный аллелизм - многие гены существуют в популяции во множестве молекулярных форм; 5. аллельность - в генотипе диплоидных организмов только две формы гена; 6. специфичность - каждый ген кодирует свой признак; 7. плейотропия - множественный эффект гена; 8. экспрессивность - степень выраженности гена в признаке; 9. пенетрантность - частота проявления гена в фенотипе; 10. амплификация - увеличение количества копий гена.
8. Гомеозисные гены. Их значение, примеры регуляции. Гомеозисные гены — гены, определяющие процессы роста и дифференцировки в организме. Гомеозисные гены кодируют транскрипционные факторы, контролирующие программы формирования органов и тканей. Гомейозисные (гомеотические) мутации, были впервые описаны в 1894 году Вильямом Бейтсоном. Они характеризуются изменением места расположения известных структур вдоль продольной оси тела животного. Мутации в гомеозисных генах могут вызвать превращение одной части тела в другую. Гомеозисными мутантами называются такие организмы, у которых на месте органа развивается орган другого типа. Например, у дрозофилы при мутации формируется конечность на месте антенны. Гомеозисные гены контролируют работу других генов и определяют превращение внешне неразличимых участков зародыши или определённого органа (ткани, участка тела). В частности, гомеозисные гены контролируют появление различий сегментов многоклеточных животных в раннем эмбриональном развитии. У насекомых гомеозисные гены играют ключевую роль в определении особенностей строения эмбриональных сегментов и структур на них (ноги, антенны, крылья, глаза). 7) структура: ГОМЕОБОКС - 180 нп, участок ДНК, кодирующий гомеодомен ГОМЕОДОМЕН - 60 ак-т, часть белковой последовательности транскрипционного фактора (TF), ответственная за связывание с ДНК (структура - helix-turn-helix) ГОМЕОЗИСНЫЕ ГЕНЫ - содержащие гомеобокс+ входящие в состав кластераза инициацию гомеозисных генов отвечают гены сегментации, за дальнейшее поддержание экспрессии - белки из сем. Polycomb (подавляют их экспрессию, локально изменяя конформацию хроматина; экспрессия. Фолиарная (классическая) теория морфогенеза цветка И.В.Гете: Презентации: Цветок – видоизмененный побег с укороченными междоузлиями. Органы цветка – преобразованные листья. Развил в трудах: (1790г.) «Опыт о метаморфозе растений»; (1810г.) «Учение о цветке». Согласно классической, или фолиарной (от лат. folium – лист) концепции, высказанной еще И.В. Гёте (1790), поддержанной А.П. Декандоллем (1813) и другими исследователями, все элементы цветка представляют собой метаморфизированные листья. Поэтому цветок определяли как видоизмененный побег с ограниченным ростом, приспособленный для осуществления всех процессов, обеспечивающих семенное размножение растений. Фенотип тройного мутанта – убедительное свидетельство в пользу фолиарной теории морфогенеза цветка Гете. АВС-модель развития цветка: АВС –модель – современная парадигма генетики развития. Согласно этой модели дифференциация органов цветка определяется работой 3 классов регулирующих генов: гены класса А отвечают за развитие чашелистиков, в сумме с генами класса В они определяют формирование лепестков, совместная работа генов класса В и С ведет к развитию тычинок, а гены С сами по себе контролируют появление пестика в центре цветка. Эти гены кодируют факторы транскрипции, которые вызывают специализацию тканей растения в процессе развития. Впоследствии были добавлены еще два класса генов: гены класса D, которые отвечают за развитие завязи в цветке, мутации по этому гену приводят к развитию плодолистиков вместо завязи, а сверхэкспрессия этих генов - к формированию завязей вместо чашелистиков и лепестков; и гены класса E, которые контролируют идентичность трех внутренних кругов. При нарушении работы этих генов одни части цветка превращаются в другие (тычинки в лепестки или лепестки в чашелистики). Модельным видом в этих исследованиях был арабидопсис, у которого был обнаружен ряд гомеозисных мутаций, при совместном действии некоторых из которых все части цветка превращались в листья. Трансформация передних разделов в задние из-за того, что у этого мутанта ген ANTP экспрессируется в голове, а не груди.
|