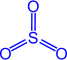
Химические свойства. 1) Сернистый ангидрид - кислотный оксид
1) Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе)
SO2 + H2O «H2SO3 K1® H+ + HSO3- K2® 2H+ + SO32- K1 = ([H+] • [HSO3-]) / [H2SO3] = 1,6 • 10-2 K2 = ([H+] • [SO32-]) / [HSO3-] = 1,3 • 10-7
H2SO3 образует два ряда солей - средние (сульфиты) и кислые (бисульфиты, гидросульфиты).
Ba(OH)2 + SO2 ® BaSO3¯(сульфит бария) + H2O Ba(OH)2 + 2SO2 ® Ba(HSO3)2(гидросульфит бария)
2) Реакции окисления (S+4 – 2ē ® S+6)
SO2 + Br2 + 2H2O ® H2SO4 + 2HBr 5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 ® 2Na2SO4; 2SO32- + O2 ® 2SO42-
3) Реакции восстановления (S+4 + 4ē ® S0)
SO2 + С –t°® S + СO2 SO2 + 2H2S ® 3S + 2H2O
Оксид серы VI
SO3 (серный ангидрид)
|