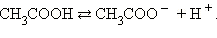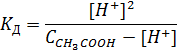Диссоциация уксусной кислоты. Константа диссоциации уксусной кислоты.
Рассмотрим уксусную кислоту. Это довольно слабая органическая кислота с формулой CH3COOH, является слабым электролитом. В воде обратимо диссоциирует на ионы:
Так как это обратимая химическая реакция, то соответственно должна быть у нее и константа диссоциации, которую мне необходимо посчитать. Обратимся к закону действующих масс, тогда константа реакции равна:
Где [H+], [CH3COO-], [CH3COOH] – равновесные концентрации для данной температуры. Преобразуем эту формулу, используя уравнения: А) Электронейтральности раствора: [H+] = [CH3COO-] Б) Материального баланса: СН = ССН3СООН = [H+] +[CH3COO-] Тогда получим новую формулу для расчета константы уксусной кислоты:
Где есть всего две неизвестных величины (вместо трех): 1) Равновесная концентрация [H+], которая может быть вычислена из рН раствора (по определению рН): рН= -lg[H+] отсюда: [H+] = 10 -рН 2) Исходная концентрация уксусной кислоты, которая нам будет дана для каждого раствора. Итак, вот мы и подошли к практической части – суть процесса нам известна, прибор и его компоненты рассмотрены, формулы для расчетов выведены.
|