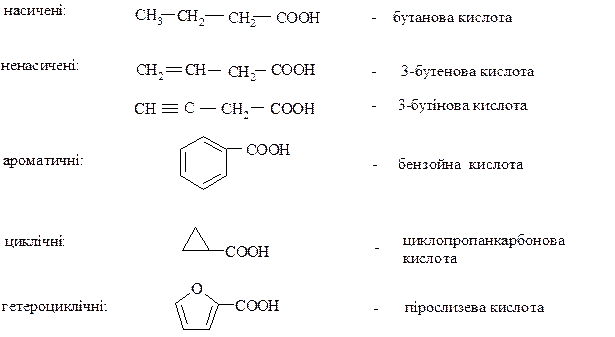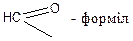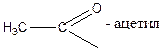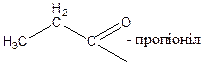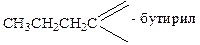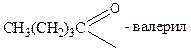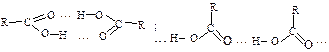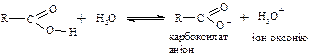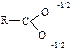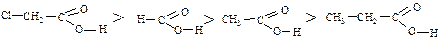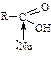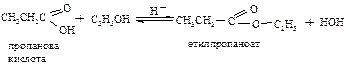Лекція 5 . КАРБОНОВІ КИСЛОТИ
Карбонові кислоти – органічні сполуки, у складі яких міститься карбоксильна група – СООН. Загальна формула R – COOH. Залежно від природи вуглецевого радикала, сполученого з карбоксильною групою, карбонові кислоти поділяють на:
За кількістю карбоксильних груп карбонові кислоти поділяють на:
Кислотам часто дають емпіричні назви, пов’язані з джерелом первісного виділення або з місцезнаходженням у природі: мурашина, оцтова, масляна та ін. За номенклатурою ІЮПАК назви кислот утворюються від назв відповідних вуглеводнів з тією ж кількістю атомів вуглецю, що і в молекулі кислоти, з додаванням закінчення – ова і слова кислота: СН3 – СН2 – СООН – пропан ова кислота Назви деяких кислот, їх ацилів і солей
Фізичні та хімічні властивості: Найпростіші кислоти за звичайних умов – безбарвні рідини, які змішуються з водою в будь-яких співвідношеннях. Кислоти з кількістю вуглецевих атомів від С4 до С9 – маслянисті рідини з неприємним запахом. Вищі кислоти – тверді речовини без запаху, нерозчинні у воді, але розчинні в органічних розчинниках. Ароматичні кислоти – кристалічні речовини.
Карбонові кислоти мають дуже високі температури кипіння порівняно з спиртами з такою самою кількістю вуглецевих атомів. Це пояснюється асоціацією молекул кислот завдяки водневим зв’язкам. Вони міцніші, ніж в асоціатах спиртів, бо зв’язок О – Н в молекулах кислот більш поляризований. Така асоціація може бути циклічною або лінійною: Карбоксильна група С є поєднанням карбонілу С = О з гідроксилом ОН, які впливають одна на одну, тому карбоксильна група – це нова функціональна група з новими властивостями.
Атоми вуглецю в – СООН групі перебуває у стані sp2-гібридизації і утворює три σ-зв’язки і один π-зв’язок. Зв’язок С = О полярний, електронна густина π-зв’язку зміщена до атома кисню. Внаслідок на атомі вуглецю виникає деякий надлишковий позитивний (δ+) заряд і він притягує до себе неподілену електронну пару атома кисню гідроксильної групи. Між неподіленою електроною парою атома кисню і π-електронами подвійного зв’язку відбувається спряження (+М):
У результаті мезомерного ефекту (+М) зменшується δ+ на карбонільному атомі вуглецю і тому карбонільна група карбонових кислот порівняно з карбонільною групою альдегідів і кетонів знижує свою здатність вступати в реакції з нуклеофільними реагентами. Крім того, за рахунок мезомерного ефекту відбувається підвищення поляризованості зв’язку О – Н; водень стає більш рухомим і здобуває здатність відщеплюватися у вигляді протона Н+. Тому карбонові кислоти у водних розчинах дисоціюють з утворенням карбоксилат-аніона і гідроксонію і змінюють забарвлення індикаторів:
У карбоксилат-аніоні обидва атома кисню перебувають на однаковій відстані від вуглецевого атома і негативний заряд не локалізується на одному атомі кисню, а рівномірно розподілений між двома атомами кисню, тобто відбувається вирівнювання зв’язків: Делокалізація електронів веде до виграшу енергії, тому карбоксилат-аніон більш стійкий, ніж сама кислота. Це друга причина дисоціації карбонових кислот. Кислотні властивості: Карбонові кислоти порівняно з мінеральними кислотами (HCL, H2SO4, HJ, HNO3 та ін.) набагато слабкіші. Ступінь диссоціації їх у водних розчинах невелика (Ка = 10-5, рКа = 4,7 – 5) і залежить від характеру і будови алкільного радикала R, наявності замісників у його вуглецевому ланцюзі. Алкільні радикали, які мають позитивний індукційний ефект (+J)(CH3 –, C2H5 –, C3H7 – та ін.) знижують кислотність. Чим більше радикал у молекулі кислоти, тим нижче ступінь диссоціації. Електроноакцепторні замісники (галогени, ОН, ОР, СООН, NН2, С6Н5–, НС2 = С–), які мають негативний індукційний ефект (-І) підвищують силу кислот. За зростанням кислотності карбонові кислоти можна розмістити у такий ряд:
Утворення солей: Карбонові кислоти при взаємодії з активними металами, основами, основними оксидами утворюють солі:
Утворення похідних кислот (реакції по карбонільному вуглецю)
У ході цих реакцій нуклеофіл:Nuˉ атакує карбонільний вуглець з розривом зв’язку С – ОН: Залежно від характеру реагента утворюються різноманітні похідні карбонових кислот. Утворення складних ефірів (реакція етерифікації)
При взаємодії карбонових кислот зі спиртами утворюються складні ефіри. Каталізаторами реакції є концентрована сірчана кислота, газоподібний HCl, кислоти Льюіса
|