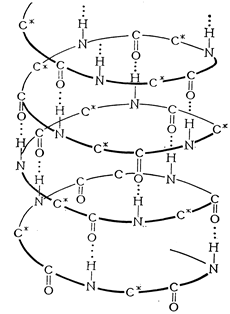
Молекулярное строение кератина
Макромолекулы белка построены из остатков a-аминокислот (мономеры), соединённых между собой пептидной связью. Схематично реакцию образования пептида из a-аминокислот можно представить следующим образом:
где R1, R2, Rn – остатки a-аминокислот В кератине шерсти обнаружено 19 остатков a-аминокислот (R1-R19), содержащих различные функциональные группы (активные центры), способные взаимодействовать как между собой, так и с отделочными препаратами – -OH, -NH2, -SH, -COOH. Отличительной особенностью шерсти является наличие в ней атомов серы. Последовательность соединения аминокислот в кератине пока не установлена. Макромолекула кератина имеет конформацию спирали, которая стабилизируется внутримолекулярными взаимодействиями активных центров, в основном за счёт образования водородных связей между –СО– и –NН– группами соседних витков спирали
Рис. 8. Схема a-спирали полипептидной цепи
|

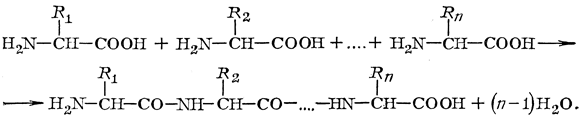 ,
,