Нейтрализация сточных вод
3.1. Кислые и щелочные сточные воды перед сбросом их в промышленную канализацию или водоемы должны быть нейтрализованы до достижения величины рН, равной 6,5-8,5. При нейтрализации сточных вод допускается смешениекислых и щелочных стоков для их взаимонейтрализации: 3.2. Пример расчета взаимной нейтрализации. Исходные данные: кислые сточные воды содержат H2SO4 - 4,7; HCl - 3,8 г/л; щелочные сточные воды содержат NaOH - 3,3; Na2CO3 - 2,9 г/л. Для расчета взаимной нейтрализации концентрации кислот и щелочей надо выразить в г-экв/л. В кислых сточных водах это составит Нa2SO4 - 4,7:49 = 0,0958 г-экв/л; НС1 - 3,8:36,5 = 0,1041 г-экв/л; итого кислот - 0,2 г-экв/л. NaOH - 3,3: 40 = 0,0825 г-экв/л; Nа2СО3 - 2,9: 53 = 0,0547 г-экв/л; итого щелочей - 0,1372 г-экв/л; где 49; 36,5; 40; 53 грамм-эквиваленты Нa2SO4, HC1, NaOH и Nа2СО3 соответственно. В результате смешения равных объемов данных сточных вод преобладают кислые стоки: 0,2-0,1372 = 0,0628 г-экв/л. Для их нейтрализации потребуется дополнительно 0,0628 г-экв/л щелочи. Это количество щелочи содержится в 0,46 л щелочной воды, что видно из следующего расчета: в 1 л содержится 0,1372 г-экв/л щелочи, а в Х л содержится 0,0628 г-экв/л щелочи, тогда Х = 0,0628:0,1372 = 0,46 л щелочной воды. Следовательно, для получения при взаимной нейтрализации воды с величиной рН = 7 надо смешивать с 1 л кислой воды 1,46 л щелочной воды. Если для расчета взаимной нейтрализации известны величины рН, то пересчет концентрации производится по формулам: для кислых стоков pH = - lg где Х - концентрация кислоты, г/л; Э - ее эквивалентная масса; для щелочных стоков pH = 14+lg где X 1 - концентрация щелочи, г/л; Э 1 - ее эквивалентная масса. 3.3. Пример расчета концентрации НNО3, имеющей величину рН = 2,02. По формуле (74) произведем следующий расчет: 2,02 = - lg где 63 - эквивалентная масса HNO3; lg 63 = 1,8, тогда 2,02 = - lg X +1,8; lg X = 1,8-2,02 = - 0,22 + 1,78; X = 0,603 HNO3 г/л (0,603 антилогарифм 1,78). 3.4. Пример расчета концентрация NaOH, имеющей величину рН =12,77. По формуле (75) произведем следующий расчет; 12,77 = 14+lg где 40 эквивалентная масса NaOH, lg 40 = 1,602, тогда 12,77 = 14+lg X 1 - 1,602; lg X 1 = 12,77-14+l,602 = 0,372; X 1 = 2,36 NaOH г/л (2,36 антилогарифм 0,372). Непрерывно действующие фильтры, загруженные кусковым мелом, известняком, магнезитом, мрамором, доломитом н другими химическими веществами, могут применяться для нейтрализации соляно-кислых и азотно-кислых сточных вод, а также серно-кислотных, содержащих не более 5 г/л H2SO4 и не содержащих солей тяжелых металлов. Если нейтрализуемая сточная вода содержит катионы металлов, то доза нейтрализующего реагента рассчитывается как на свободную кислоту, так и на концентрацию металлов. При достижении оптимального значения величины рН-6,5-8,5 основное количество металлов выделяется в осадок в виде соответствующих гидроксидов. 3.5. Расчет количества образующегося осадка производится по формуле (80) СНиП 2.04.03-85 Третий член в данной формуле не учитывается, если его значение отрицательное. 3.6. Объем образующегося осадка рассчитывается по формуле (81) СНиП 2.04.03-85 Wmud = (10 . M)/(100 -Pmud). 3.7. Пример расчета количества осадка, образующегося при нейтрализации кислых сточных вод, содержащих катионы металлов, производится по формулам (80) и (81) СНиП 2.04.03-85. Исходные данные. Нейтрализуемая сточная вода содержит 7 г/л FeSO4, и 10,3 г/л H2SO4. Применяемая для нейтрализации известь содержит 50 % активной СаО (A). Расход нейтрализуемой сточной воды qw = 120 м3/сут. Определяем количество сухого вещества в осадке M по формуле (80) СНиП 2.04.03-85. По реакции FeSO4,+CaO+H2O FeSO4 + СаО + H2О 152 66 36 90 7 A1, A2 A3 A 1 = (7 . 56)/152 = 2,6 г/л; A 2 = (7 . 136)/152 = 6,2 г/л; A 3 = (7 . 90)/152 = 4,1 г/л. Затем по реакции H2SO4+CaO - CaSО4+H2О находим значения E1 и E2: H2SО4 +СаО 98 66 136 10,3 E1 Е2, E1 = (10,3 . 56)/98 = 5,9 г/л; E2 = 10,3 . 136/98 = 14,3 г/л. Найденные значения подставляются в формулу (80) СНиП 2.04.03-85. Определяем объем осадка, образующегося при нейтрализации 1 м3 сточной воды при влажности его 90 % по формуле (81) СНиП 2.04.03-85 Wmud = (10×31,1)/(100-90) = 3,l %. Общее количество влажного осадка будет 31,1 . 120:1000 = 4,7 т/сут. Заметим, что влажность осадка всегда должна быть меньшей или равной 100 % минус количество сухого вещества. Если, например, количество сухого вещества M = 31,1 кг/м3, то влажность осадка не может быть более 96,9 %, а всегда равна или меньше этой величины. Ориентировочное количество осадка, образующегося в зависимости от концентрации кислоты и ионов тяжелых металлов в нейтрализуемой воде и выделяющегося в накопителях, предназначенных для складирования его, может быть принято по следующим данным: концентрация кислоты и ионов тяжелых металлов, кг/м3.. 5 1015 20 30 40 50 количество осадков, м3, накапливаемых за 1 год, от каждого 1 м3/сут нейтрализованной воды... 33 51 65 76 93 108 118
|

 , (74)
, (74) , (75)
, (75)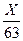 ; 2,02 = - (lg Х - lg63) = - lg X + lg63,
; 2,02 = - (lg Х - lg63) = - lg X + lg63, ; 12,77 = 14 +(lg X 1-lg40)
; 12,77 = 14 +(lg X 1-lg40) .
. CaSО4+Fe(OH)2 находим значения A1, A2 и A3:
CaSО4+Fe(OH)2 находим значения A1, A2 и A3: г/м3.
г/м3.


