МОЛЕКУЛЯРНАЯ ФИЗИКА
1. Количество молей (количество вещества): µ [кг/моль] – молярная масса вещества, NA – число Авогадро. Число молекул в массе m вещества: Масса одной молекулы: Молярная масса смеси:
2. Уравнение Клапейрона – Менделеева:
Р[Па] – давление газа, V[м3] – объем газа, Т – абсолютная температура, выраженная в Кельвинах, Т [К] = t [ºC] + 273, ΔТ [К] = Δt [ºC]. R – универсальная газовая постоянная, R = 8,31 Или 3. Изопроцессы в идеальных газах: 1) (Т = const):
2) (Р = const):
3) (V = const):
4. Средняя энергия теплового движения одной молекулы идеального газа:
i = 5 – двухатомный газ. Средняя квадратичная скорость молекул идеального газа:
5. Насыщенный пар: Рнп и ρнп – табличные величины, зависят от температуры.
Абсолютная влажность воздуха ≡ плотности пара. Относительная влажность воздуха:
Давление насыщенного водяного пара при 100ºС равно атмосферному. Точка росы – температура, при которой ранее ненасыщенный пар становится насыщенным.
|

 .
. .
. .
.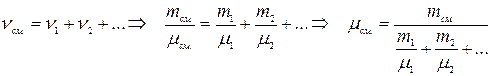 .
. ; т.к.
; т.к.  .
.
 , где
, где  - концентрация молекул, N – число молекул в объеме V, k – постоянная Больцмана,
- концентрация молекул, N – число молекул в объеме V, k – постоянная Больцмана, 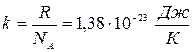 .
.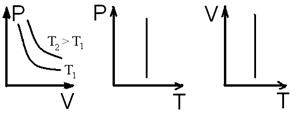 Изотермический процесс
Изотермический процесс .
. Изобарический процесс
Изобарический процесс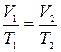 .
.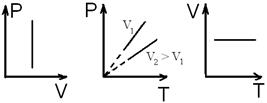 Изохорический процесс
Изохорический процесс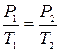 .
. , i = 3 – одноатомный газ,
, i = 3 – одноатомный газ, .
. .
.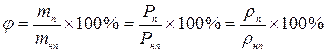 .
.


