Термодинамика восстановления железа.
Билет № 9 Fe2O3 → Fe3O4 → FeO → Fe (выше 570 °С) или Fe2O3 → Fe3O4 → Fe (ниже 570 °С). При этом в соответствии с диаграммой Fe—О в системе наряду с низшими оксидами и металлом возникает ряд твердых растворов. Каждая из реакций восстановления оксидов железа газообразными восстановителями: 3Fe2O3+ СО = 2 Fe3O4 + СО2 + 37,25 МДж; Fe3O4 + СО = 3FeO + СО2 — 20,96 МДж; FeO + СО = Fe + СО2 + 13,65 МДж; 3Fe2O3+ Н2 = 2 Fe3O4 + Н2О — 4,20 МДж 1; Fe3O4 + Н2 = 3FeO + Н2О — 62,41 МДж; FeO + Н2 = FeO + Н2O – 27,80 МДж
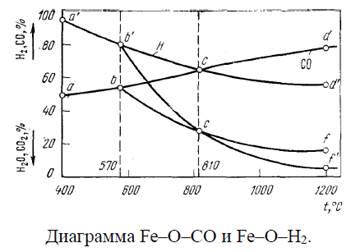
К основным различиям термодинамики восстановления оксидов железа монооксидом углерода и водородом относятся следующее. Ниже 810 °C водород как восстановитель слабее монооксида углерода, его равновесная концентрация в смеси больше, чем равновесное содержание монооксида углерода. Выше 810 °C водород становится более сильным восстановителем, чем монооксид углерода. Суммарный тепловой эффект реакции восстановления оксидов железа водородом отрицательный и в 4 раза больше положительного суммарного теплового эффекта реакций восстановления оксидов железа монооксидом углерода. Приведенные данные относятся к идеальным системам. В реальных условиях действуют неучитываемые факторы (образование твердых растворов и др.). Например, положение линий равновесия восстановления вюстита Fe1-yO меняется в зависимости от концентрации вакансий у ионов железа в решетке вюстита при восстановлении водородом.
|