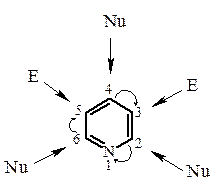Строение и общая характеристика реакционной способности. Пиридин является наиболее ярко выраженным представителем ароматических гетероциклов
Пиридин является наиболее ярко выраженным представителем ароматических гетероциклов. По строению он аналогичен бензолу, только вместо одного звена ─СН═ содержит в кольце звено ─N═. Согласно методу валентных схем, он представляет собой резонансный гибрид нескольких предельных структур, основной вклад в который вносят структуры, подобные бензолу по Кекуле.
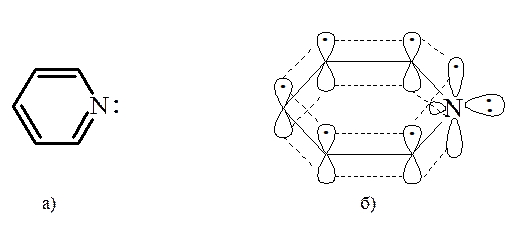
Все атомы углерода и атом азота находятся в состоянии sp2 -гибридизации, и все σ-связи (С─С и С─N) лежат в одной плоскости. У атома азота из трех его гибридных орбиталей две образуют σ-связи с атомами углерода, а третья содержит неподеленную пару электронов. На негибридной р -орбитали, расположенной перпендикулярно плоскости σ-скелета, находится один электрон, благодаря которому атом азота участвует в образовании единого электронного облака с р -орбиталями пяти атомов углерода. Атом азота с такой электронной конфигурацией называют пиридиновым. Молекула пиридина отвечает критериям ароматичности, сформулированным для ароматических углеводородов, а именно имеет плоский σ-скелет, сопряженную замкнутую электронную систему, охватывающую все атомы цикла и содержащую шесть π-электронов, удовлетворяя формуле Хюккеля (4n + 2 при n=1). В этом отношении пиридин изоэлектронен бензолу.
Электронное строение пиридинового атома азота (а) и образование сопряженной системы в молекуле пиридина (б). Одно из существенных отличий пиридина от бензола состоит в проявлении основных свойств с образованием устойчивых солей. Пиридиновый атом азота способен взаимодействовать и со многими электрофильными реагентами, проявляя тем самым и нуклеофильные свойства.
Другое отличие заключается в пониженной активности пиридина и его производных в реакциях электрофильного замещения, что не свойственно бензолу. Направление атаки обусловлено неравномерным распределением электронной плотности в кольце. Электрофильные реагенты атакуют β; -положения (атомы С-3 и С-5), нуклеофильные реагенты α; - и γ; -положения (атомы С-2, С-4 и С-6).
|