Теория атома, предложенная Бором.
В 1913 году датский ученый Нильс Бор, применяя принцип квантитативности к решению проблем строения атома и характеристики спектра атома, устранил противоречия в созданной Резерфордом модели атома. Предложенная в 1911 году Резерфордом модель атома напоминала солнечную систему: в центре ее было расположено ядро, вокруг него по круговым орбитам вращались электроны. Ядро было положительно заряжено, электроны обладали отрицательным электрическим зарядом. Силы притяжения в Солнечной системе в атоме заменялись электрическими силами. Положительный электрический заряд ядра атома, который равнялся порядковому номеру элемента в периодической системе Менделеева, уравновешивался отрицательным электрическим зарядом электронов. Поэтому атом являлся электрически нейтральным. Анализ планетарной модели атома в рамках классической электродинамики содержал два невозможных противоречия. Первое из этих противоречий состояло в том, что электроны для того, чтобы не потерять свою устойчивость, должны вращаться вокруг ядра. Как известно, круговое движение характеризуется центробежным ускорением. Согласно законам классической электродинамики ускоренно движущиеся электроны должны непременно излучать электромагнитную энергию. Однако в этом случае электроны за очень короткий промежуток (10–8 секунды), расходуя свою энергию на излучение, должны упасть на ядро. Это нам хорошо известно из повседневного опыта. Если бы электроны упали на ядро, тело, состоящее из них, например стоящий перед нами стол, изменил бы свои размеры в 10 тысяч раз. Второе противоречие планетарной модели атома связано с тем, что постепенно приближающийся в результате излучения к ядру электрон для беспрерывного изменения своей частоты спектр излучения атома должен быть целым. Опыт же показывает, что спектр излучения атома линейный. Другими словами, планетарная модель атома Резерфорда не уживаются с электродинамикой Максвелла. Квантовая теория атома, которая могла бы решать оба эти противоречия (так называемая «теория Бора о строении атома») была выдвинута Н.Бором. Содержание этой теории формировалось из следующих положений, объединенных в единую, целую идею: 1) закономерности линейного спектра атома водорода; 2) ядерная модель атома, предложенная резерфордом; 3) квантовый характер излучения и поглощения света. Выдвинутая Н.Бором для объяснения структуры атома новая гипотеза опиралась на три не уживающиеся с принципами классической физики постулата. Первый постулат: в каждом атоме существует несколько стационарных состояний электронов (стационарные орбиты). Электромагнитные волны, движущиеся по стационарным орбитам атома, не излучаются, не поглощаются. Второй постулат: атом только тогда излучает или поглощает порцию энергии, когда электрон переходит из одного стационарного состояния в другое. Третий постулат? Электрон движется вокруг ядра по таким круговым стационарным орбитам, на которых в момент импульса электрона постоянная Планка полностью уподобляется относительной 2p: где m, n, r – соответственно масса электрона, скорость и радиус стационарной орбиты, по которой он движется, n=1,2,3… – целые числа. Эти постулаты заложили начало новому периоду в изучении свойств и строения атома. Первый постулат показал ограниченность классической физики, а в особых случаях неприемлемость ее законов к стационарным состояниям. Не так легко согласиться с идеей о излучении энергии электронами на определенно отобранных орбитах. В эту же минуту возникает вопрос: «Почему?» Однако в связи с тем, что этот постулат был адекватен результатам экспериментов, физики вынуждены были его принять. Из второго постулата вытекает вывод о том, что энергия атома излучается порциями. Переход электрона с одной орбиты на другую обязательно сопровождается целыми числами энергетических квантов. Так, состояние электронов в атоме характеризуется 4 квантовыми числами – главное, орбитальное, магнитное и орбитальное квантовое число. Главное квантовое число (n) определяет энергию электрона в областях ядра, в сложных атомах порядковый номер слоя электронов. Орбитальное квантовое число (l) характеризует коррективы, привносимые в энергию атома одновременным движением атомов. Спиновое квантовое число (s) определяет специальный механический момент, характеризующий вращательное движение электронов. Постулаты Бора объясняли устойчивость атома: в стационарных состояниях электрон без существования внешних причин не излучает электромагнитную энергию. Только теперь стало ясно, почему при неизменной оценке состояний атомы химических элементов не излучают электромагнитные волны. Модель атома, предложенная Бором, не смотря на то, что дала точное описание атома водорода, состоящего из одного протона и одного электрона, и это описание довольно хорошо согласовывалось с фактами опыта, позднее применение этой модели к многоэлектронным атомам столкнулось с определенными трудностями. Как бы точно ни старались теоретики описать движение и орбиту электронов в атоме, различие между теоретическими результатами и данными экспериментов оставалось большим. Однако в ходе развития квантовой теории стало ясно, что эти различия связаны в основном со свойством волновости у электронов. Волновая длина электрона, движущегося по круговой орбите в атоме, входила в состав измерений атома и составляла приблизительно 10–8 см. Хотя движение частиц, присущих какой-либо системе, только в том случае можно достаточно точно описать как механическое движение материальной точки по замкнутой орбите, когда волновая длина частицы по сравнению с системой изменений будет настолько мала, что не будет приниматься во внимание. Другими словами, нужно принять во внимание, что электрон – не точка, не крепкий «шарик», у него есть внутренняя структура, которая может меняться в зависимости от присущих ему состояний. Однако в этом случае детали внутренней структуры электрона остаются не известными. Здесь становится ясным, что принципиально не возможно представить структуру атома на основе представлений об орбитах предположительно точечных электронов, поэтому внутренние орбиты атома стали идеальными объектами, они даже не существуют в действительности. Согласно их волновой природе электроны и их электрический заряд якобы неравномерно распределены по атому и обладают по времени в некоторых точках малой, в других – большей плотностью электронов. Описание распределения плотности заряда электрона внутри атома дано в квантовой механике: в некоторых точках плотность заряда электрона достигает максимальной отметки. Кривая, объединяющая точки максимальных отметок плотности заряда электрона, формально называется орбитой электрона. Вычисленная в теории Бора траектория атома водорода совпала с кривой, проходящей через точки максимальных отметок средней плотности заряда, что в свою очередь полностью соответствует экспериментальным данным. Теория Бора словно очерчивает линию границы первого этапа развития современной физики. Атомная теория Бора на основе добавления небольшого количества новых рассуждений была последней попыткой описать структуру атома на основе классической физики. Постулаты Бора показали, что классическая физика не способна объяснить подобные результаты самых простых опытов, связанных со структурой атома. Чуждые классической физике постулаты Бора, нарушив ее цельность, в свою очередь смогли объяснить лишь небольшую область экспериментальных данных. Поэтому, рождается представление о том, что постулаты Бора, открывшие новые, до этого времени неизвестные науке свойства материи, в то же время частично, не полностью отражали их. Теория Бора, и его постулаты которые не могли быть применены к сложным атомам, были бессильны в объяснении существенных явлений физики также как дифракция и интерференция не могли объяснить волновые свойства света и материи. На многие вопросы, связанные со структурой атома, были получены ответы только в результате развития квантовой механики. Было выяснено, что Боровскую модель атома нельзя буквально понимать такой, какой была прежде. Процессы атома неправильно было бы наглядно описывать в формах механических моделей, созданных по аналогии с явлениями макромира. Вскоре стало известно, что точно определенные для макромира представления о времени и пространства непригодны для описания микрофизических явлений. Постепенно физики-теоретики превратили атом в еще более абстрактную систему - совокупность ненаблюдаемых уравнений.
|

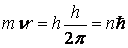 .
.


