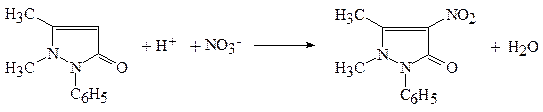Аналитические реакции на нитрат-ион.
1. С дифениламином в среде концентрированной H2SO4(ГФ). Дифениламин окисляется азотной кислотой вначале в бесцветный N,N-дифенилбензидин, затем в "дифенилбензидин фиолетовый": Методика: в сухую фарфоровую чашку (тигель) помещают кристаллик дифениламина, прибавляют несколько капель концентрированной H2SO4и 1-2 капли раствора, содержащего нитрат-ион. Появляется интенсивная синяя окраска. Реакция чувствительна, но неспецифична. Мешают окислители - NO2-, Fe3+, MnO4-и т.д., и восстановители – S2-, SO32-, S2O32-, I-и др.
2. С металлической медью в среде концентрированной H2SO4(ГФ). 2 NaNO3+ Cu + 2 H2SO4 Методика: к сухому веществу (0,002-0,005 г нитрата-иона) прибавляют по 2-3 капли воды и концентрированной серной кислоты, кусочек металлической меди и нагревают, выделяются бурые пары оксида азота(IV). 3. С сульфатом железа(II). 2 NaNO3+ 6 FeSO4+ 4 H2SO4 NO + FeSO4 Методика: к 2 каплям испытуемого раствора нитрата на холоду прибавляют кристаллик FeSO4и осторожно по стенке пробирки концентрированную H2SO4. Наблюдают коричневое кольцо вследствие образования сульфата нитрозожелеза(II) [Fe(NO)]SO4. Мешают I-, Br-, а также анионы-окислители. 4. С антипирином в среде концентрированной серной кислоты с образованием нитроантипирина красного цвета.
Методика: в сухую фарфоровую чашку помещают 2 капли исследуемого раствора, добавляют 1 каплю 5% водного раствора антипирина и 4-8 капель концентрированной серной кислоты, осторожно перемешивают. Наблюдают интенсивное красное окрашивание, последующее разбавление водой приводит к переходу красной окраски в карминово-красную. 5. С раствором KMnO4в сернокислой среде (ГФ). Наблюдают неисчезающую розовую окраску раствора (в отличие от NO2-аниона, обесцвечивающего раствор KMnO4). Обнаружению NO3--иона реакциями с дифениламином и сульфатом железа(II) мешает присутствие NO2--иона, поэтому необходимо знать способы разрушения нитрит-ионов.
|

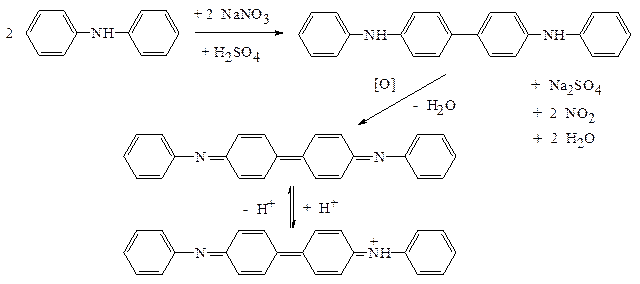
 CuSO4+ 2 NO2 + Na2SO4+ 2 H2O
CuSO4+ 2 NO2 + Na2SO4+ 2 H2O