Законам ідеальних газів підпорядковуються тільки розріджені реальні гази. У всіх інших випадках властивості ідеальних і реальних газів істотно розрізняються. Наприклад, коефіцієнт стисливості 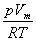 ; з рівняння Менделеева-Клапейрона для ідеальних газів завжди дорівнює одиниці, проте він залежить від тиску й температури для реальних газів. Тому при досить високих тисках усі реальні гази менш стискувані, ніж ідеальні (навіть незалежно від температури). Дослідження таких характеристик, як питома теплоємність, в'язкість і т. ін., також виявили відмінності у властивостях ідеальних і реальних газів. Основна причина цих відмінностей полягає в тому, що поведінка молекул реальних газів відрізняється від поведінки молекул ідеальних газів. В усіх тілах, незалежно від їхнього агрегатного стану, молекули взаємодіють між собою, причому сили взаємодії значною мірою залежать від відстані між молекулами. Ці сили мають електромагнітну й особливу квантову природу. У силу того, що виявляються вони на відстані
; з рівняння Менделеева-Клапейрона для ідеальних газів завжди дорівнює одиниці, проте він залежить від тиску й температури для реальних газів. Тому при досить високих тисках усі реальні гази менш стискувані, ніж ідеальні (навіть незалежно від температури). Дослідження таких характеристик, як питома теплоємність, в'язкість і т. ін., також виявили відмінності у властивостях ідеальних і реальних газів. Основна причина цих відмінностей полягає в тому, що поведінка молекул реальних газів відрізняється від поведінки молекул ідеальних газів. В усіх тілах, незалежно від їхнього агрегатного стану, молекули взаємодіють між собою, причому сили взаємодії значною мірою залежать від відстані між молекулами. Ці сили мають електромагнітну й особливу квантову природу. У силу того, що виявляються вони на відстані  м і швидко зменшуються зі збільшенням відстані, їх називають короткодіючими.
м і швидко зменшуються зі збільшенням відстані, їх називають короткодіючими.