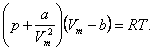Поправка на притягання молекул
Дія сил притягання газу призводить до появи додаткового тиску на газ, що називають внутрішнім тиском. За обчисленнями Ван-дер-Ваальса, внутрішній тиск обернено пропорційний до квадрата молярного об'єму: Врахувавши всі ці поправки, ми одержуємо рівняння Ван-дер-Ваальса для 1 моль реального газу: Для довільної кількості речовини v рівняння Ван-дер-Ваальса має вигляд:
де поправки а і b — постійні для кожного газу величини, що визначаються експериментально. Виводячи рівняння, Ван-дер-Ваальс зробив ряд наближень і спрощень, тому воно не дає абсолютно точного результату, однак узгоджується з дослідом набагато краще, ніж рівняння стану ідеального газу.
|

 . де а — постійна Ван-дер-Ваальса, що характеризує сили міжмолекулярного притягання.
. де а — постійна Ван-дер-Ваальса, що характеризує сили міжмолекулярного притягання.