Молекули реальних газів
Якщо для ідеального газу прийнято, що частинки не взаємодіють одна з одною на відстані, то в реальних газах існують сили міжмолекулярного притягання й відштовхування. Сили взаємного відштовхування молекул виявляються при зіткненні молекул газу між собою і зі стінками посудини. При зіткненнях молекули поводяться подібно до абсолютно пружних кульок, діаметр яких залежить тільки від хімічної природи газу і називається ефективним діаметром молекули (d). Незалежно від того, який саме газ розглядається, порядок величини d залишається постійним (10-10 м). Між кульками-молекулами діють сили взаємного притягання. Вони швидко зменшуються зі збільшенням відстані г між молекулами газу і при r>10-9м практично дорівнюють нулю. Таким чином, реальний газ наближається за властивостями до ідеального зі збільшенням середньої відстані між молекулами, тобто зі зменшенням густини газу. Багато газів (азот, водень, гелій, кисень, повітря та ін.) можна вважати ідеальними вже при густині, що відповідає атмосферному тиску й нормальній температурі. Так, концентрація молекул газу за цих умов складає приблизно 1025 м-3, а середня відстань між молекулами
де п0 — концентрація молекул газу. Якщо розглянути сумарну площу поверхні молекул, що містяться в 1 м3 газу, то вона дорівнюватиме:
Ця величина в багато разів перевищує площу поверхні стінок посудини. Це свідчить про те, що зіткнення молекул між собою відбуваються набагато частіше, ніж зі стінками. Тому знехтувати взаємними зіткненнями частинок так само, як нехтують власним обсягом молекул газу, не можна.
|

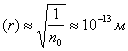 , тобто настільки велика, що силами взаємного притягання молекул можна знехтувати. Власним об'ємом молекул також нехтують, оскільки сумарний власний обсяг усіх молекул, що містяться в 1 м3 газу, складає
, тобто настільки велика, що силами взаємного притягання молекул можна знехтувати. Власним об'ємом молекул також нехтують, оскільки сумарний власний обсяг усіх молекул, що містяться в 1 м3 газу, складає




