Применение озона обусловлено его свойствами
1. сильного окисляющего агента: · для стерилизации изделий медицинского назначения · при получении многих веществ в лабораторной и промышленной практике · для отбеливания бумаги · для очистки масел 2. сильного дезинфицирующего средства: · для очистки воды и воздуха от микроорганизмов (озонирование) · для дезинфекции помещений и одежды Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие токсинов после обработки. Тогда как при хлорировании возможно образование существенного количества токсинов и ядов, например, диоксина. Сера
1. Простое вещество Сера - твердое вещество. Молекула ромбической серы (наиболее распространенной модификации) состоит из 8 атомов: S8. Тем не менее серу в уравнениях реакций записывают как просто S. Сера взаимодействует с кислородом, галогенами, водородом, другими неметаллами, металлами. Из сложных веществ - с щелочами, кислотами-окислителями. Большинство реакций серы протекает при нагревании.
2. Оксиды серы Сера образует 2 оксида: SO2 (сернистый газ) и SO3 (есть жидкая и твердая аллотропные модификации). Оба они - кислотные, оба взаимодействуют с водой: SO2 + H2O SO3 + H2O = H2SO4 + Q Строение SO2:
Получение SO2: 1) Горение серы S + O2 = SO2 2) Взаимодействие сульфитов с сильными кислотами Na2SO3 + 2HCl = 2NaCl + SO2 + H2O 3) Взаимодействие концентрированной серной кислоты с умеренными восстановителями Cu + 2H2SO4конц. Строение SO3:
Получение SO3: Каталитическое окисление SO2 2SO2 + O2
3. Кислородсодержащие кислоты серы Сернистая кислота H2SO3 - слабая и неустойчивая. Серная кислота H2SO4 - сильная, устойчивая, в концентрированном виде - сильный окислитель. Реакции металлов с серной кислотой могут приодить, в зависимости от ее концентраиии и от активности металла, к разным продуктам восстановления S+6. Cu + 2H2SO4конц. = CuSO4 + S+4O2 + 2H2O Zn + 2H2SO4конц. = ZnSO4 + S+4O2 + 2H2O 3Zn + 4H2SO4 60% = 3ZnSO4 + S0 + 4H2O 4Zn + 5H2SO4 40% = 4ZnSO4 + H2S-2 + 5H2O Zn + H2SO4 20% = ZnSO4 + H2 Неметаллы концентрированная серная кислота окисляет до высшей степени окисления. Поскольку дело происходит в растворе, в сильнокислой среде, то образуются соответствующие кислоты (угольная кислота Н2СО3 неустойчива, поэтому при реакции с углеродом образуется СО2). Исключение – реакция серы с концентрированной серной кислотой: серная кислота (S+6), конечно, не может окислить серу до S+6, образующийся продукт - SO2 (степень окисления серы +4): S + 2H2SO4конц. = 3SO2 + 2H2O Продукт восстановления концентрированной серной кислоты - тоже SO2. Концентрированная серная кислота активно поглощает воду. Она отбирает ее даже у органических соединений, обугливая их.
4. Сероводород H2S - ядовитый газ с запахом тухлых яиц, плохо растворимый в воде. Его водный раствор - слабая кислота. Сероводород - хороший восстановитель за счет S-2. Получение H2S: 1) Взаимодействие серы с водородом (при нагревании): H2 + S 2) Взаимодействие сульфидов с сильными кислотами: ZnS + 2HCl = ZnCl2 + H2S Свойства H2S: 1. Физические свойства: газ без цвета, с запахом тухлых яиц. 2. Образование характерных осадков: образует черные осадки при пропускании в растворы солей меди, свинца, серебра: H2S + CuSO4 = CuS¯ + H2SO4 H2S + Pb(NO3)2 = PbS¯ + 2HNO3 H2S + 2AgNO3 = Ag2S¯ + 2HNO3 3. Окислительно-восстановительные свойства: окислительных свойств не проявляет, является восстановителем. Например, обесцвечивает бумажку, смоченную подкисленным раствором перманганата калия: 5H2S + 8KMnO4 + 7H2SO4 = 4K2SO4 + 8MnSO4 + 12H2O |

 H2SO3
H2SO3
 CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O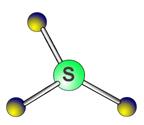
 2SO3
2SO3


