Неограниченно смешивающихся жидкостей
В практике широко используются многочисленные растворы, состоящие из двух и более хорошо растворимых друг в друге жидкостей. Наиболее простыми являются смеси (растворы), состоящие из двух жидкостей – бинарные смеси. Закономерности, найденные для таких смесей, можно использовать и для более сложных. К таким бинарным смесям можно отнести: бензол-толуол, спирт-эфир, ацетон-вода, спирт-вода и т.д. В этом случае в паровой фазе содержатся оба компонента. Давление насыщенного пара смеси будет слагаться из парциальных давлений компонентов. Так как переход растворителя из смеси в парообразное состояние, выражаемое его парциальным давлением, тем значительнее, чем больше содержание его молекул в растворе, Рауль нашел, что «парциальное давление насыщенного пара растворителя над раствором равно произведению давления насыщенного пара над чистым растворителем при той же температуре на его мольную долю в растворе»:
где Уравнение (8.6) является математическим выражением закона Рауля. Для описания поведения летучего растворенного вещества (второго компонента бинарной системы) применяется это же выражение:
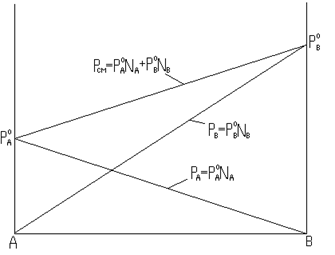
Общее давление насыщенного пара над раствором будет равно (закон Дальтона):
Зависимость парциального и общего давления паров смеси от ее состава показана на рис. 8.3, где на оси ординат отложено давление насыщенных паров, а на оси абсцисс – состав раствора в мольных долях. При этом по оси абсцисс содержание одного вещества (А) убывает слева направо от 1,0 до 0 мольных долей, а содержание второго компонента (В) одновременно в том же направлении увеличивается от 0 до 1,0. При каждом определенном составе общее давление насыщенного пара равняется сумме парциальных давлений. Общее давление смеси изменяется от давления насыщенного пара одной индивидуальной жидкости Законы Рауля и Дальтона часто используются для оценки пожарной опасности смесей жидкостей.
Состав смеси, мольные доли Рис. 8.3 Диаграмма состав раствора – давление насыщенного пара
Обычно состав паровой фазы не совпадает с составом жидкой фазы и паровая фаза обогащена более летучим компонентом. Это различие можно изобразить и графически (график имеет вид аналогичный графику на рис. 8.4, только на оси ординат взята не температура а давление). В диаграммах, представляющих зависимость температур кипения от состава (диаграмма состав-температура кипения рис. 8.4), обычно принято строить две кривые, одна из которых связывает эти температуры с составом жидкой фазы, а другая с составом пара. Нижняя кривая относится к составам жидкости (кривая жидкости), а верхняя – к составам пара (кривая пара). Поле, заключенное между двумя кривыми, соответствует двухфазной системе. Любая точка, находящаяся в этом поле, отвечает равновесию двух фаз – раствора и насыщенного пара. Состав равновесных фаз определяется координатами точек, лежащих на пересечении изотермы, проходящей через кривые, и данную точку. При температуре t1 (при данном давлении) будет кипеть жидкий раствор состава х1 (точка а1 на кривой жидкости), пар, равновесный с этим раствором, обладает составом х2 (точка b1 на кривой пара). Т.е. жидкости состава x1 будет соответствовать пар состава х2. Исходя из выражений: взаимосвязь между составом жидкой и паровой фаз может быть выражена соотношением:
Рис. 8.4. Диаграмма состав-температура кипения двойных смесей.
Реальное давление насыщенного пара индивидуальной жидкости при данной температуре есть характерная величина. Практически нет жидкостей, которые бы обладали одинаковыми значениями давления насыщенного пара при одной и той же температуре. Поэтому В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении. Первый закон Коновалова является теоретической основой для разделения жидких растворов на исходные компоненты путем фракционной перегонки. Например, система, характеризуемая точкой К, состоит из двух равновесных фаз, состав которых определяется точками a и b: точка а характеризует состав насыщенного пара, точка b - состав раствора. По графику можно провести сопоставления составов паровых и жидких фаз для любой точки, заключенной в плоскости между кривыми. Реальные растворы. Закон Рауля не выполняется для реальных растворов. Отклонение от закона Рауля существует двух типов: 1. парциальное давление растворов больше давлений или летучести паров идеальных растворов. Общее давление пара больше аддитивной величины. Такие отклонения называются положительными, например, для смесей (рис. 8.5 а, б) CH3COCH3-C2H5OH, CH3COCH3-CS2, C6H6- CH3COCH3, H2O-CH3OH, C2H5OH-CH3OCH3, CCl4-C6H6 и др.;
а
Рис. 8.5. Зависимость общего и парциальных давлений пара от состава: а – для смесей с положительным отклонением от закона Рауля; б – для смесей с отрицательным отклонением от закона Рауля.
2. парциальное давление растворов меньше давлений паров идеальных растворов. Общее давление пара меньше аддитивной величины. Такие отклонения называются отрицательными. Например, для смеси: H2O-HNO3; H2O-HCl; CHCl3-(CH3)2CO; CHCl3-C6H6 и т.д. Положительные отклонения наблюдаются в растворах, у которых разнородные молекулы взаимодействуют с меньшей силой, чем однородные. Это облегчает переход молекул из раствора в паровую фазу. Растворы с положительным отклонением образуются с поглощением теплоты, т.е. теплота смешения чистых компонентов будет положительной, происходит увеличение объема, уменьшение ассоциации. Отрицательные отклонения от закона Рауля возникают в растворах, у которых происходит усиление взаимодействия разнородных молекул, сольватация, образование водородных связей, образование химических соединений. Это затрудняет переход молекул из раствора в газовую фазу.
|

 , (8.6)
, (8.6)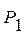 - давление насыщенного пара растворителя над смесью;
- давление насыщенного пара растворителя над смесью; 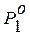 - давление насыщенного пара над чистым растворителем; N – мольная доля растворителя в смеси.
- давление насыщенного пара над чистым растворителем; N – мольная доля растворителя в смеси. . (8.7)
. (8.7)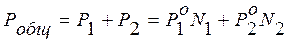 . (8.8)
. (8.8) до давления насыщенного пара второй чистой жидкости
до давления насыщенного пара второй чистой жидкости  .
.
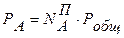 ,
, 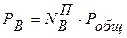 ,
,  ,
,  ,
,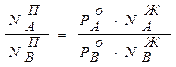 . (8.9)
. (8.9)
 всегда больше или меньше
всегда больше или меньше 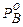 . Если
. Если  >
>  , т.е. состав паровой фазы обогащен компонентом А. Изучая растворы, Д.П. Коновалов (1881г.) сделал обобщение, получившее название первого закона Коновалова.
, т.е. состав паровой фазы обогащен компонентом А. Изучая растворы, Д.П. Коновалов (1881г.) сделал обобщение, получившее название первого закона Коновалова.
 б
б


