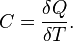| Вид системы
| Характеристика
| Примеры
|
| Открытая
| Возможен обмен с внешней средой веществом и энергией
| Человеческое тело
|
| Замкнутая
| Невозможен обмен с внешней средой веществом, возможен обмен энергией
| Закрытая колба с реагентами
|
| Изолированная
| Невозможен обмен с внешней средой ни веществом, ни энергией
| Термос, сосуд Дьюара
|
| Адиабатически изолированная
| Невозможен обмен с внешней средой тепловой энергией, возможен обмен веществом
|
|
Одна и та же система может находиться в различных состояниях. Каждое состояние системы характеризуется определенным набором значений термодинамических параметров. К термодинамическим параметрам относятся температура, давление, плотность, концентрация и т.п. Изменение хотя бы только одного термодинамического параметра приводит к изменению состояния системы в целом. При постоянстве термодинамических параметров во всех точках системы (объема) термодинамическое состояние системы называют равновесным.
Различают гомогенные и гетерогенные системы. Гомогенные системы состоят из одной фазы, гетерогенные – из двух или нескольких фаз. Фаза – это часть системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела. Примером гомогенной системы может служить водный раствор. Но если раствор насыщен и на дне сосуда есть кристаллы солей, то рассматриваемая система – гетерогенна (есть граница раздела фаз). Другим примером гомогенной системы может служить простая вода, но вода с плавающим в ней льдом – система гетерогенная.
2 вопрос
Для количественного описания поведения термодинамической системы вводят параметры состояния - величины, которые однозначно определяют состояние системы в заданный момент времени. Параметры состояния могут быть найдены только на основании опыта. Термодинамический подход требует, чтобы они могли быть измеримы опытным путём с помощью макроскопических приборов. Число параметров велико, однако не все из них имеют существенное значение для термодинамики. В простейшем случае любая термодинамическая система должна обладать четырьмя макроскопическими параметрами: массой M, объёмом V, давлением p и температурой T. Первые три из них определяются достаточно просто и хорошо известны из курса физики.
3 вопрос
| Законы идеальных газов
|  
|
| |
В XVII – XIX веках были сформулированы опытные законы идеальных газов. Кратко напомним их.
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
График изохорического процесса на РV -диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ - и VT -диаграммах (рис. 1.6). Уравнение изохоры:
|
| 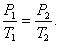
|
| (1.4.1)
| 
Рис. 1.6
Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
|
| 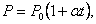
|
| (1.4.2)
| где Р0 – давление при 0 °С, α - температурный коэффициент давления газа равный 1/273 град-1. График такой зависимости на Рt -диаграмме имеет вид, показанный на рисунке 1.7.
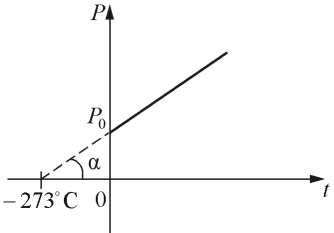
Рис. 1.7
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
График изобарического процесса на VT -диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV - и РT -диаграммах (рис. 1.8).
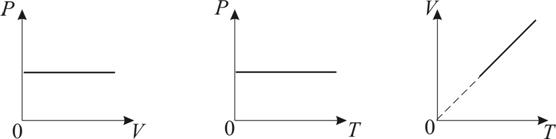
Рис. 1.8
Уравнение изобары:
|
| 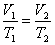 . .
|
| (1.4.3)
| Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде
|
| 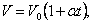
|
| (1.4.4)
| где α =1/273 град -1- температурный коэффициент объёмного расширения. График такой зависимости на Vt диаграмме имеет вид, показанный на рисунке 1.9.
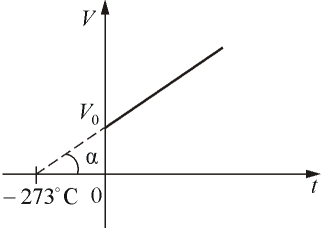
Рис. 1.9
3. Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
График изотермического процесса на РV -диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT - и РT -диаграммах (рис. 1.10).

Рис. 1.10
Уравнение изотермы:
|
| 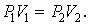
|
| (1.4.5)
| 4. Адиабатический процесс (изоэнтропийный):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA =6,02·1023 молекул (число Авогадро).
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
|
| 
|
| (1.4.6)
| Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
При  , давление смеси газов: , давление смеси газов:
|
| 
|
| (1.4.7)
| 8. Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа
|
4 вопрос
газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
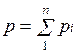
Парциальное давление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
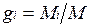 .
.
Очевидно, что 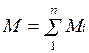
 и
и  .
.
Массовые доли часто задаются в процентах. Например, для сухого воздуха  ;
; 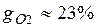 .
.
Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: 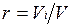 .
.
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i -го компонента:
 ; (2.1)
; (2.1)
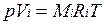 .
.
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
 . (2.2)
. (2.2)
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона  ,откуда
,откуда  . Объемные доли также часто задаются в процентах. Для воздуха
. Объемные доли также часто задаются в процентах. Для воздуха  ,
,  .
.
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси 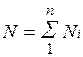 , а мольная доля компонента будет равна
, а мольная доля компонента будет равна  .
.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля 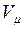 на число молей этого компонента, т. е.
на число молей этого компонента, т. е.  а объем смеси — по формуле
а объем смеси — по формуле  . Тогда
. Тогда  , и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
, и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
Газовая постоянная смеси газов. Просуммировавуравнения (2.1) для всех компонентов смеси, получим 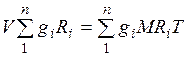 . Учитывая
. Учитывая 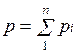 , можно записать
, можно записать
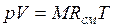 , (2.3)
, (2.3)
где
 . (2.4)
. (2.4)
5 вопрос
Полная энергия термодинамической системы представляет собой сумму кинетической энергии движения всех тел, входящих в систему, потенциальной энергии взаимодействия их между собой и с внешними телами и энергии, содержащейся внутри тел системы. Если из полной энергии вычесть кинетическую энергию, характеризующую макроскопическое движение системы как целого, и потенциальную энергию взаимодействия её тел с внешними макроскопическими телами, то оставшаяся часть будет представлять собой внутреннюю энергию термодинамической системы.
Внутренняя энергия термодинамической системы включает в себя энергию микроскопического движения и взаимодействия частиц системы, а так же их внутримолекулярную и внутриядерную энергии.
Полная энергия системы (а, следовательно, и внутренняя энергия) также как потенциальная энергия тела в механике может быть определена с точностью до произвольной константы. Поэтому, если любые макроскопические движения в системе и взаимодействия её с внешними телами отсутствуют, можно принять "макроскопические" составляющие кинетической и потенциальной энергий равными нулю и считать внутреннюю энергию системы равной её полной энергии. Такая ситуация имеет место в случае, когда система находится в состоянии термодинамического равновесия.
Введём характеристику состояния термодинамического равновесия - температуру. Так называется величина, зависящая от параметров состояния, например, от давления и объёма газа, и являющаяся функцией внутренней энергии системы. Эта функция обычно имеет монотонную зависимость от внутренней энергии системы, то есть растёт с ростом внутренней энергии.
Температура термодинамических систем, находящихся в состоянии равновесия, обладает следующими свойствами:
Если две равновесные термодинамические системы, находятся в тепловом контакте и имеют одинаковую температуру, то совокупная термодинамическая система находится в состоянии термодинамического равновесия при той же температуре.
Если какая-либо равновесная термодинамическая система имеет одну и ту же температуру с двумя другими системами, то эти три системы находятся в термодинамическом равновесии при одной и той же температуре.
Таким образом, температура есть мера состояния термодинамического равновесия. Для установления этой меры уместно ввести понятие теплопередачи.
Теплопередачей называется передача энергии от одного тела к другому без переноса вещества и совершения механической работы.
Если между телами, находящимися в тепловом контакте друг с другом, теплопередача отсутствует, то тела имеют одинаковые температуры и находятся в состоянии термодинамического равновесия друг с другом.
Если в изолированной системе, состоящей из двух тел, эти тела находятся при разных температурах, то теплопередача будет осуществляться таким образом, чтобы энергия передавалась от более нагретого тела менее нагретому. Этот процесс будет продолжаться до тех пор, пока температуры тел не сравняются, и изолированная система из двух тел не достигнет состояния термодинамического равновесия.
Для возникновения процесса теплопередачи необходимо создание потоков теплоты, то есть требуется выход из состояния теплового равновесия. Поэтому равновесная термодинамика не описывает процесс теплопередачи, а только его результат - переход в новое равновесное состояние. Описание самого процесса теплопередачи выполнено в шестой главе, посвящённой физической кинетике.
В заключении необходимо отметить, что если одна термодинамическая система обладает более высокой температурой, чем другая, то она не обязательно будет обладать и большей внутренней энергией, несмотря на возрастание внутренней энергии каждой системы с повышением её температуры. Например, больший объём воды может обладать большей внутренней энергией даже при более низкой температуре, чем у меньшего объёма воды. Однако, в этом случае теплопередача (перенос энергии) будет происходить не от тела с большей внутренней энергией к телу с меньшей внутренней энергие
6 вопрос
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяемая отношением бесконечно малогоколичества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T [1]:
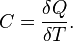
7 вопрос



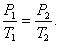

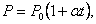
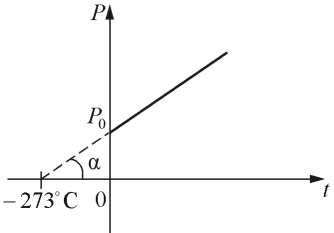

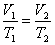 .
.
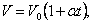
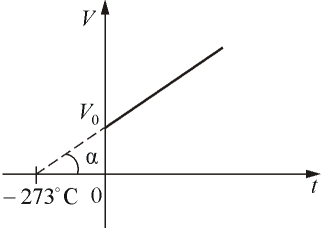

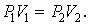

 , давление смеси газов:
, давление смеси газов:
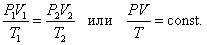
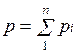
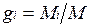 .
.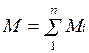
 и
и  .
. ;
; 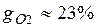 .
.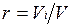 .
. ; (2.1)
; (2.1)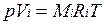 .
. . (2.2)
. (2.2) ,откуда
,откуда  . Объемные доли также часто задаются в процентах. Для воздуха
. Объемные доли также часто задаются в процентах. Для воздуха  ,
,  .
.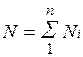 , а мольная доля компонента будет равна
, а мольная доля компонента будет равна  .
.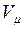 на число молей этого компонента, т. е.
на число молей этого компонента, т. е.  а объем смеси — по формуле
а объем смеси — по формуле  . Тогда
. Тогда  , и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
, и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.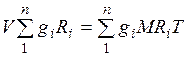 . Учитывая
. Учитывая 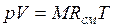 , (2.3)
, (2.3) . (2.4)
. (2.4)