Адиабатный процесс – это процесс, при котором рабочее тело не обменивается теплотой с окружающей средой (dq=0). Для получения графика процесса в p-v координатах выполним некоторые преобразования.
В соответствии с первым законом термодинамики dq=cv·dT+p·dv=c·dT, где с – теплоёмкость термодинамического процесса. Тогда можно записать, что

| (4.15)
|
Продифференцируем уравнение состояния идеального газа и запишем

| (4.16)
|
Так как R=cp-cv, то выражение (4.15) можно переписать с учётом (4.16) следующим образом:

| (4.17)
|
Выполним преобразования выражения (4.17).

| (4.18)
|
Разделим выражение (4.18) на (cv-c)·p·v и получим:
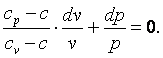
| (4.19)
|
Обозначим  , тогда
, тогда
Следовательно
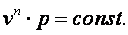
| (4.20)
|
В адиабатном процессе dq=0, то есть c·dT=0. Поэтому c=0. Значит в адиабатном процессе 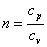 . Эту величину принято обозначать буквой
. Эту величину принято обозначать буквой  и называть показателем адиабаты.
и называть показателем адиабаты.
Поэтому в p-v координатах адиабатный процесс изображается неравнобокой гиперболой vk·p=const (рис. 4.4). Так как k>1, то адиабата проходит круче гиперболы. Адиабатный процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).

| |
| Рис. 4.4. График адиабатного
процесса в p-v координатах
|
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T1; p2·v2=R·T2. Так как в адиабатном процессе p1·v1k=p2·v2k, то  ,
,  ,
, 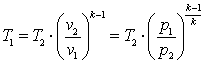 .
.
Приращение внутренней энергии газа 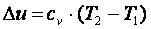 .
.
Так как 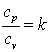 , а
, а  , то
, то 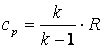 , а
, а  . Поэтому
. Поэтому
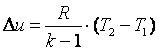
| (4.21)
|
Работа газа в адиабатном процессе выполняется за счёт его внутренней энергии. Так как в адиабатном процессе отсутствует обмен теплотой с окружающей средой, то в соответствии с первым законом термодинамики имеем l+Δu=0 или l=-Δu. Поэтому

| (4.22)
|
Изменение энтальпии газа в адиабатном процессе может быть определено исходя из следующих соображений:
Так как 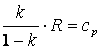 , то в итоге получим
, то в итоге получим

| (4.23)
|
Энтропия газа в адиабатном процессе не изменяется, так как dq=0. Поэтому в T-s координатах адиабатный процесс изображается прямой линией, параллельной оси температур.
7,8 вопрос – политопный процесс







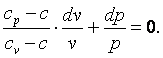
 , тогда
, тогда



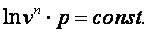
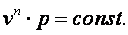
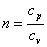 . Эту величину принято обозначать буквой
. Эту величину принято обозначать буквой  и называть показателем адиабаты.
и называть показателем адиабаты.
 ,
,  ,
, 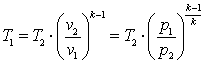 .
.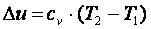 .
.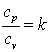 , а
, а  , то
, то 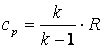 , а
, а  . Поэтому
. Поэтому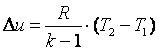


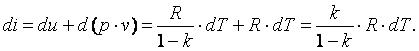
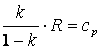 , то в итоге получим
, то в итоге получим



