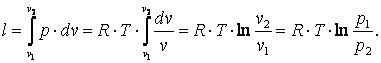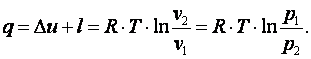Термодинамические процессы: изохорный, изобарный, изотермический, адиабатный, политропный
4.2.1.Изохорный процесс (v=const) Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv -координатах график процесса представляет собой прямую линию, параллельную оси p. Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’).
Запишем для точек 1 и 2 уравнения состояния: p1·v=R·T1; p2·v=R·T2. Следовательно, для изохорного процесса
Приращение внутренней энергии газа
Работа газа
так как dv=0. Энтальпия газа iv=u+p·v, а div=du+d(p·v)=du+p·dv+v·dp=du+v·dp. Поэтому
Энтропия То есть
4.2.2.Изобарный процесс (p=const) В p-v координатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’). Запишем для точек 1 и 2 уравнения состояния: p·v1=R·T1; p·v2=R·T2.
Следовательно, для изобарного процесса
Приращение внутренней энергии газа Используя выражение (4.5), можно показать, что в изобарном процессе энтропия газа
4.2.3.Изотермический процесс (T=const) В p-v координатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T; p2·v2=R·T. Следовательно, для изотермического процесса p1·v1=p2·v2=const. Приращение внутренней энергии газа
Работа газа
Теплота, подводимая в процессе
Изменение энтальпии газа Δi=Δu+Δ(p·v)=0. Изменение энтропии газа
|



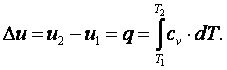
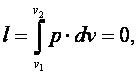
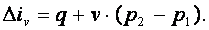

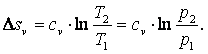


 Работа газа
Работа газа 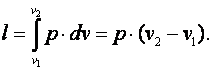 Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.