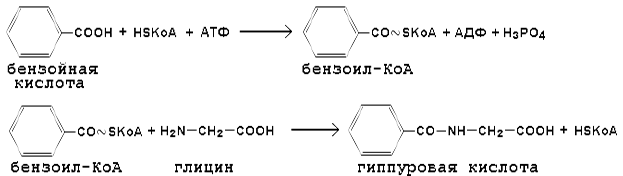Фазы метаболизма ксенобиотиков.
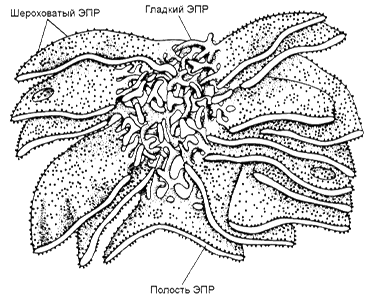
Метаболизм ксенобиотиков включает две стадии (фазы): 1) фаза модификации - процесс изменения структуры ксенобиотика, в результате которого освобождаются или появляются новые полярные группировки (гидроксильные, карбоксильные аминные). Это происходит в результате реакций окисления, восстановления, гидролиза. Образующиеся продукты становятся более гидрофильными, чем исходные вещества. 2) фаза конъюгации - процесс присоединения к молекуле модифицированного ксенобиотика различных биомолекул при помощи ковалентных связей. Это облегчает выведение ксенобиотиков из организма. 5.1. Фаза модификации. Основной тип реакций этой фазы биотрансформации - микросомальное окисление. Оно происходит при участии ферментов монооксигеназной цепи переноса электронов. Эти ферменты встроены в мембраны эндоплазматического ретикулума гепатоцитов (рисунок 1).
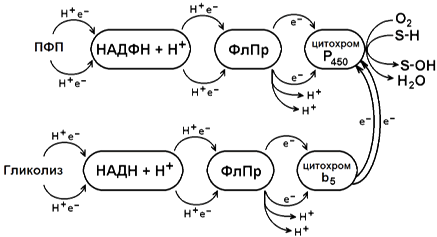
Источником электронов и протонов в этой цепи является НАДФН+Н +, который образуется в реакциях пентозофосфатного пути окисления глюкозы. Промежуточным акцептором Н + и е — служит флавопротеин, содержащий кофермент ФАД. Конечное звено в цепи микросомального окисления - цитохром Р-450.
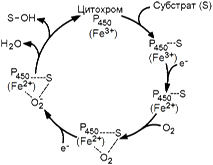
Цитохром P-450 - сложный белок, хромопротеин, в качестве простетической группы содержит гем. Своё название цитохром Р-450 получил в связи с тем, что образует прочный комплекс с оксидом углерода СО, имеющий максимум поглощения при 450 нм. Цитохром Р-450 обладает низкой субстратной специфичностью. Он может взаимодействовать с большим количеством субстратов. Общее свойство всех этих субстратов - неполярность. Цитохром Р-450 активирует молекулярный кислород и окисляемый субстрат, изменяя их электронную структуру и облегчая процесс гидроксилирования. Механизм гидроксилирования субстратов с участием цитохрома Р-450 показан на рисунке 2.
Рисунок 2. Механизм гидроксилирования субстрата при участии цитохрома Р-450. В этом механизме условно можно выделить 5 основных этапов: 1. Окисляемое вещество (S) образует комплекс с окисленной формой цитохрома Р-450; 2. Происходит восстановление этого комплекса электроном с НАДФН; 3. Восстановленный комплекс соединяется с молекулой O 2; 4. О 2 в составе комплекса присоединяет ещё один электрон с НАДФН; 5. Комплекс распадается с образованием молекулы Н 2 О, окисленной формы цитохрома Р-450 и гидроксилированного субстрата (S-ОН). В отличие от митохондриальной дыхательной цепи, при переносе электронов в монооксигеназной цепи не происходит аккумулирования энергии в виде АТФ. Поэтому микросомальное окисление является свободным окислением. В большинстве случаев гидроксилирование чужеродных веществ снижает их токсичность. Однако в ряде случаев могут образоваться продукты с цитотоксическими, мутагенными и канцерогенными свойствами. Примеры реакций, протекающих с участием цитохрома Р-450: 1) С-гидроксилирование алифатических соединений:
2) С-гидроксилирование ароматических соединений:
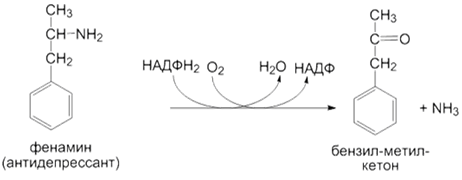
3) Окислительное дезаминирование субстратов:
4) N-деалкилирование субстратов:
5) O-деалкилирование субстратов:
6) S-деалкилирование субстратов:
7) N-окисление субстратов:
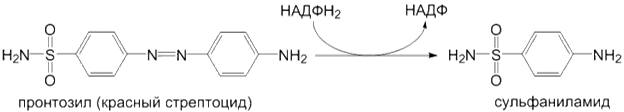
8) S-окисление субстратов: Некоторые окислительные реакции I фазы биотрансформации могут происходить без участия монооксигеназной цепи эндоплазматического ретикулума. Это реакции, которые катализируют ферменты: алкогольдегидрогеназа и альдегиддегидрогеназа (окисление алифатических спиртов), ксантиноксидаза (окисление производных пуринов), тирозингидроксилаза (образование катехоламинов), моноаминооксидаза (окисление биогенных аминов). Реакции восстановления. Кроме окислительных реакций метаболизма ксенобиотиков, микросомальные ферментные системы катализируют реакции восстановления нитро- и азосоединений в амины. В качестве кофермента в этих реакциях участвует НАДФН 2. Примером может служить реакция восстановления пронтозила в сульфаниламид:
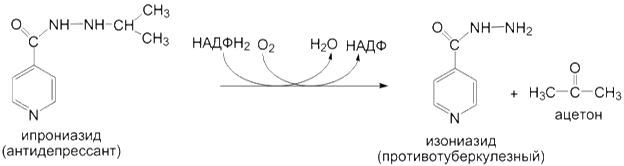
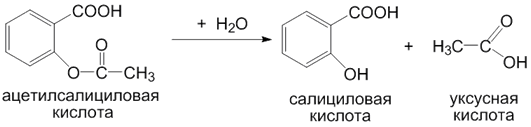
Реакции гидролиза. Микросомальные ферменты катализируют также гидролиз амидных и сложноэфирных связей в молекулах ксенобиотиков. В результате реакций гидролиза атропин превращается в тропин и троповую кислоту, а ипрониазид - в изоникотиновую кислоту и изопропилгидразин. Ещё одним примером является гидролиз ацетилсалициловой кислоты:
5.2. Реакции конъюгации ксенобиотиков. К реакциям конъюгации относятся глюкуронидная, сульфатная, ацетильная, метильная и пептидная конъюгация. Глюкуронидная конъюгация. Реакцию катализирует глюкуронилтрансфераза, коферментом является активная форма глюкуроновой кислоты - уридин-дифосфоглюкуроновая кислота (УДФ-глюкуроновая кислота). В реакцию вступают спирты, фенолы, карбоновые кислоты, тиолы и амины. Из эндогенных субстратов можно отметить билирубин, стероидные гормоны, витамин D. Примером реакции может служить образование фенилглюкуронида:
Сульфатная конъюгация. Реакцию катализирует сульфотрансфераза. В качестве активной формы сульфата выступает З-фосфоаденозин-5-фосфосульфат (ФАФС). Субстратами чаще всего служат спирты и фенолы, реже - аминосоединения. В качестве примера реакции можно привести конъюгацию индоксила, который образуется в результате гидроксилирования индола(см. 33.5.1., реакции гидроксилирования ароматических соединений):
Продукт этой реакции в виде калиевой соли (животный индикан) выводится почками. Определение содержания индикана в моче может быть использовано для оценки интенсивности процессов гниения белков в кишечнике. Ацетильная конъюгация. Ацетилированием называют присоединение к молекуле ксенобиотика или его метаболита остатка уксусной кислоты. Ацетилированию подвергаются вещества, содержащие свободную аминогруппу (алифатические и ароматические амины, аминокислоты, гидразины, гидразиды). Из эндогенных субстратов можно упомянуть аминосахара (глюкозамин, галактозамин) и биогенные амины. Катализируют реакции ацетилирования ферменты ацетилтрансферазы, донором ацетильной группы является ацетил-КоА. Пример реакции - ацетилирование изониазида (изоникотиноилгидразида):
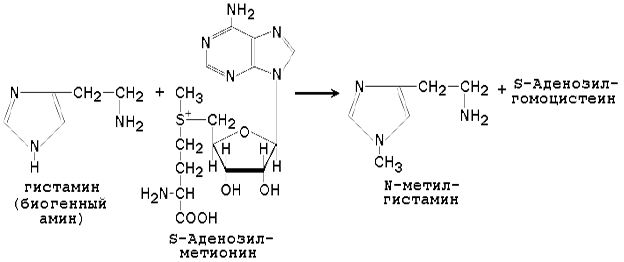
Метильная конъюгация (метилирование). Реакции метилирования (присоединения метильной группы) катализируют ферменты метилтрансферазы или трансметилазы. Донором метильной группы является активная форма аминокислоты метионина - S-аденозилметионин. Метилирование характерно для некоторых эндогенных субстратов (гуанидинацетат, норадреналин, фосфатидилэтаноламин). Субстратами для метилтрансфераз служат фенолы, тиолы и амины. Пример реакции - метилирование гистамина:
Метилирование ксенобиотиков по сравнению с другими реакциями конъюгации имеет одну особенность. В результате присоединения метильной группы продукт реакции не становится более гидрофильным. Тем не менее метильная конъюгация выполняет важную роль, так как в результате метилирования устраняются чрезвычайно реакционноспособные SH- и NН-группы. Пептидная конъюгация - взаимодействие ксенобиотиков или их метаболитов с аминокислотами (глицин, глутамин, таурин и др.) при помощи пептидных (амидных) связей. Особенность этой разновидности конъюгации заключается в том, что ксенобиотик вступает в реакцию в активной форме (в других типах конъюгации активируется биомолекула). Пептидная конъюгация характерна для соединений, содержащих карбоксильные группы. Примером может служить конъюгация бензойной кислоты с глицином, в результате чего образуется гиппуровая кислота:
Эта реакция лежит в основе пробы Квика, используемой для оценки обезвреживающей функции печени. В реакции конъюгации с глицином (H 2 N-CH 2 -COOH) и таурином (H 2 N-CH 2 -CH 2 -SO 3 H) вступают также желчные кислоты (например, холевая), образуя "парные соединения" или конъюгаты.
|