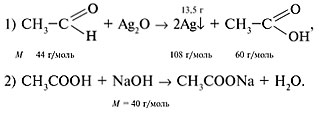Изомерия и номенклатура карбоновых кислот
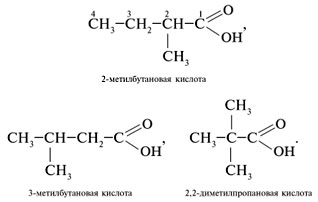
Задание 1. Составить формулы изомеров состава C5H10O2. Назвать вещество. Решение Молекулярная формула C5H10O2 подчиняется общей формуле C n H2 n O2, это может быть предельная одноосновная кислота или сложный эфир. 1. Составить структурные формулы карбоновых кислот, отвечающих составу С5H10O2:
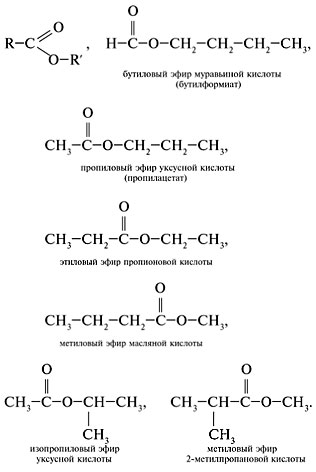
2. Составить формулы сложных эфиров, отвечающих составу C5H10O2:
Задание 2. Составить формулу пентен-2-овой кислоты. Для этого вещества составить формулы изомеров и назвать их. Решение 1. Составить структурную формулу по названию: «пентен-2-овая». а) «Пентен» – 5 атомов углерода в цепочке: С–С–С–С–С. б) Слово «кислота» означает, что присутствует карбоксильная группа:
в) Запись «ен-2» сообщает о двойной связи между 2-м и 3-м атомами С:
г) Расставить недостающие атомы водорода:
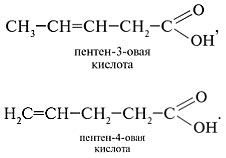
2. Составить формулы изомеров по положению двойной связи.
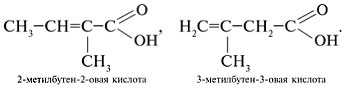
3. Составить формулы структурных изомеров:
4. Составить формулы изомерных сложных эфиров:
Алгоритм 7.2. Решение расчетных задач по теме «Альдегиды. Задача 1. Какой объем уксусной эссенции плотностью 1,07 г/мл надо взять для приготовления столового уксуса объемом 200 мл и плотностью 1,007 г/мл? Массовая доля уксусной кислоты в уксусной эссенции равна 80%, а в уксусе – 6%. Решение 1. Записать условие задачи. Дано:
V (уксуса) = 200 мл,
Найти: V (эссенции). 2. Определить массу раствора уксуса: m = 3. Определить массу уксусной кислоты в уксусе: m = 201,4•0,06 = 12,1 г. 4. Определить массу уксусной эссенции, которая содержит 12,1 г уксусной кислоты: m = 12,1/0,8 = 15,1 г. 5. Определить объем уксусной эссенции: V = 15,1/1,07 = 14,1 мл. Ответ. V (уксусной эссенции) = 14,1 мл. Задача 2. Уксусная кислота содержит примеси уксусного альдегида и этанола. Образец кислоты массой 20 г обработали избытком аммиачного раствора оксида серебра и получили 13,5 г осадка. На нейтрализацию такого же образца кислоты израсходовали 25,65 мл раствора с массовой долей гидроксида натрия 30% и плотностью 1,3 г/см3. Вычислить массовые доли примесей в кислоте. Решение 1. Записать условие задачи. Дано: m (кислоты) = 20 г, m (Ag) = 13,5 г, V (р-ра NaOH) = 25,65 мл,
Найти:
2. Составить уравнения реакций:
3. Найди массу альдегида по уравнению реакции (1): m (СН3С(О)Н) = 44•13,5/216 = 2,75 г. 4. Вычислить массу NaOH, вступившего в реакцию: m (NaOH) = 25,65•1,3•0,3 = 10 г. 5. Определить массу уксусной кислоты, расходуемой в реакции (2): m (СН3СООН) = 10•60/40 = 15 г. 6. Найти массу этанола в исходной смеси: m (С2Н5ОН) = 20 – 15 – 2,75 = 2,25 г. 7. Рассчитать массовые доли спирта и альдегида в кислоте:
Ответ.
|

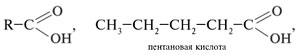

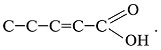


 (укс. эссенции) = 1,07 г/мл,
(укс. эссенции) = 1,07 г/мл, (СН3СООН) = 80% (в эссенции),
(СН3СООН) = 80% (в эссенции),