Общая характеристика карбоновых кислот.
Карбоновые кислоты алифатического ряда (жирного) характеризуются наличием карбоксильной группы в молекуле. Карбоновые кислоты можно рассматривать как
От угольной кислоты (Acidum carbonicum) и произошло название карбоновые кислоты. Наряду с карбоксильной группой молекулы карбоновых кислот могут содержать и др. функциональные группы, например: Гидроксильную: (гидроксикарбоновые к-ты) аминогруппу: аминокислоты
- Присутствие карбоксильной группы увеличивает растворимость вещества в воде. - Растворимость еще более увеличивается у солей карбоновых кислот. - Введение данной группы в молекулу вещества, как правило, снижает его физиологическую активность. Поэтому свободные карбоновые кислоты в медицинской практике применяются редко. Это также объясняется тем, что кислоты диссоциируют на ионы с отщеплением Н+, который придает карбоновым кислотам раздражающее действие, чем сильнее кислота тем больше диссоциация и больше они проявляют раздражающее и прижигающее действие:
Потому чаще применяются соли и эфиры, метал или остаток спирта вместо водорода уменьшает или полностью снимает раздражающее действие. - С увеличением молекулярной массы кислоты (радикала) константа диссоциации падает и понижается растворимость. Химические свойства карбоновых кислот в основном определяются свойствами карбоксильной группы: А) карбоновые кислоты растворяются в щелочах и карбонатах, образуя соли. Б) с солями тяжелых металлов в нейтральной среде образуют осадки различного цвета В) со спиртами образуют сложные эфиры, имеющие характерные запахи.
Все эти свойства используются в фармацевтическом анализе лекарственных препаратов. Подлинность карбоновых кислот определяются по характеру катиона и аниона. Лекарственными средствами карбоновых кислот являются: калия ацетат, кальция лактат, натрия цитрат для инъекций, натрия гидроцитрат для инъекций, кальция глюконат. Физиологическое действие этих препаратов обусловлено в основном катионом.
2. КАЛЬЦИЯ ЛАКТАТ Calcii lactase С6H10CaO6 * 5H2O
Это гидроксикарбоновая оксикислота М =308,3 А) Получение. Получают в процессе промышленного производства молочной кислоты. При молочнокислом брожении сахаристых веществ (например глюкозы) образуется молочная кислота.
Б) Физические свойства:белый мелкий порошок имеет в составе кристаллическую воду и на воздухе быстро выветривается. Без запаха. В воде растворяется медленно с образованием мутных растворов. Легко растворяется в горячей воде, очень мало растворим в спирте, эфире и хлороформе.
- с сульфатами (или H2SO4), образуется осодок белый CaSO4
|

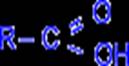
 HO – C – OH R – C –OH
HO – C – OH R – C –OH


 O O
H2CO3
O O
H2CO3
 R– C–CООН
OH
R– C–CООН
OH


 R–COOH R–COO - + H+
R–COOH R–COO - + H+
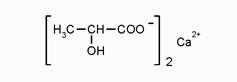

 C6H12O6 2CH3 –CH (ОН)-CООН Молочную кислоту нейтрализуют CaCO3, получают кальция лактат
C6H12O6 2CH3 –CH (ОН)-CООН Молочную кислоту нейтрализуют CaCO3, получают кальция лактат
 В) Определение подлинности:
В) Определение подлинности: ГФ - определяют ион Са2+ оксалатом аммония (NH4)2C2O4
ГФ - определяют ион Са2+ оксалатом аммония (NH4)2C2O4 (NH4)2C2O4 + Ca2+ CaC2O4 белый, растворяется в минеральных кислотах и нерастворим в уксусной.
(NH4)2C2O4 + Ca2+ CaC2O4 белый, растворяется в минеральных кислотах и нерастворим в уксусной. ГФ - анион (лактат) определяют действием окислителя – раствора KMnO4 в кислой среде. Лактат-ион выделяет ацетальдегид, его обнаруживают по запаху яблок, а раствор обесцвечивается из-за перехода Mn7+ в Mn2+
ГФ - анион (лактат) определяют действием окислителя – раствора KMnO4 в кислой среде. Лактат-ион выделяет ацетальдегид, его обнаруживают по запаху яблок, а раствор обесцвечивается из-за перехода Mn7+ в Mn2+ 5 [CH3 CH (OH)COO]2Ca + 4KMnO4 +11 H2SO4 10 CH3 – CОН
5 [CH3 CH (OH)COO]2Ca + 4KMnO4 +11 H2SO4 10 CH3 – CОН  +2 K2SO4 + + 4 MnSO4 +10 CO2 + CaSO4 + 16 H2O
+2 K2SO4 + + 4 MnSO4 +10 CO2 + CaSO4 + 16 H2O


