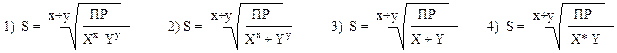Вводный контроль.
Тестирование по теме занятия. Примерный вариант теста: 1. Растворимым веществом является: 1) карбонат кальция 2) сульфит бария 3) бромид серебра 4) фосфат натрия 2. Нерастворимым веществом является: 1) карбонат калия 2) сульфат натрия 3) иодид серебра 4)гидрофосфат натрия 3. Система, в которой образуется осадок: 1) нитрат калия + хлорид бария 2) бромид рубидия + карбонат натрия 3) сульфат калия + йодид бария 4) фосфат натрия + хлорид аммония 4. Система, в которой образуется осадок: 1) гидроксид калия + хлорид бария 2) бромид рубидия + нитрат серебра 3) сульфат аммония + йодид натрия 4) гидросульфид калия + хлорид натрия 5. Вещество, меньше всех растворяющееся в воде: 1) фторид кальция ПР CaF2 = 4,0* 10-11 2) фосфат кальция ПР Са3(РО4)2 = 2,0*10-29 3) карбонат кальция ПР СаСО3 = 3,8* 10-9 4) сульфат кальция ПР СаSO4 = 2,0*10-5 6. Состав основного неорганического вещества зубной эмали: l) Ca10(PO4)6CO3 2) Ca10(PO4)6(OH)2 3) Ca10(PO4)6F2 4) Ca3(PO4)2 7. Состав основного неорганического вещества костной ткани l) Ca10(PO4)6CO3 2) Ca10(PO4)6(OH)2 3) Ca10(PO4)6F2 4) Ca3(PO4)2 8. Сульфат кальция CaSO4 лучше растворяется в: 1) речной воде 2) дистиллированной воде 3) морской воде 4) водопроводной воде 9. Антидотное действие сульфата магния MgSO4 no отношению к образованию камней проявляется в том, что: 1) сульфат магния растворяет оксалатные камни 2) сульфат магния растворяет уратные камни 3) соосаждается вместе с оксалат-ионами и выводится из организма 4) соосаждается вместе с уратными камнями и выводится из организма 10. Оксалатные камни в качестве основного вещества содержат: 1) ураты калия и натрия 2) карбонаты магния и кальция 3) оксалаты кальция 4) сулъфаты кальция и бария 11. Желчные камни в качестве основного вещества содержат: 1) сульфат бария 2) оксалаты и ураты кальция 3) карбонаты магния и кальция 4) желчные кислоты и их соли 12. Камни, образующиеся при избыточном потреблении пищи, богатой пуриновыми основаниями: 1) уратные 2) желчные 3) оксалатные 4) карбонатные 13. Выражением для расчета константы растворимости фосфата кальция Са3(РО4)2 является: 1) ПР =[Ca2+] [PO43-] 2) ПР = [Ca2+]3[PO43-]2 3) ПР = [Ca2+]3[PO43-] 4) ПР = [Ca2+] [PO43-]2 14. Выражением для расчета константы растворимости сульфида алюминия Al2S3 является: 1) ПР =[Al3+] [S2-] 2) ПР = [Al3+]3 [S2-]2 3) ПР = [Al3+]2 [S2-] 4) ПР = [Al3+]2 [S2-]3 15. Выражением для расчета константы растворимости карбоната цинка является: 1) ПР =[Al3+] [S2-] 2) ПР = [Al3+]3 [S2-]2 3) ПР = [Al3+]2 [S2-] 4)ПР = [Al3+]2 [S2-]3 16. Единицей измерения растворимости является: 1) моль/г 2) г/моль 3) моль/л 4) г/мл 17. Уравнением для расчета растворимости является:
18. Осадок, образующийся при взаимодействии нитрата серебра AgNO3 с хроматом калия К2СгО4: 1) хромат серебра 2) металлический хром 3) нитрат калия 4) металлическое серебро 19. Осадок, образующийся при взаимодействии нитрата серебра AgNO3 с гидроксидом калия КОН: 1) гидроксид серебра* 2) нитрат калия 3) оксид серебра 4) металлическое серебро 20. Осадок, образующийся при взаимодействии перманганата калия КМnО4 с сульфитом калия K2SO3 в нейтральной среде: 1) сера свободная 2) оксид марганца 3) сульфит марганца 4) сульфид марганца 21. Осадок, образующийся при взаимодействии тиосульфата натрия Na2S2O3 с разбавленной серной кислотой: 1) сера свободная 2) сульфит натрия 3) сульфид натрия 4) сульфат натрия 22. Условие образования осадка сульфата свинца: 1) C2 Pb2+) • C2(SO42-) > ПР (PbSO4) 2) C2(Pb2+) • C2(SO42-) < ПР (PbSO4) 3) C2(Pb2+) • C(SO42-) > ПР (PbSO4) 4) C(Pb2+) • C(SO42-) > ПР (PbSO4) * 23. Условие образования осадка фосфата серебра: 1) C3(Ag+) • C(PO43-) < ПР (Ag3PO4) 2) C (Ag+) • C(PO43-) > ПР (Ag3PO4) 3) C3(Ag+) • C(PO43-) > ПР (Ag3PO4) 4) C(Ag+) • C3(PO43-) > ПР (Ag3PO4) 24. Условие образования осадка сульфата бария: 1) C(Ba2+) • C(SO42-) < ПР (BaSO4) 2) C2(Ba2+) • C2(SO42-) < ПР (BaSO4) 3) C2(Ba2+) • C(SO42-) > ПР (BaSO4) 4) C(Ba2+) • C(SO42-) > ПР (BaSO4) 25. Формула расчета растворимости фосфата серебра:
26. Формула расчета растворимости сульфата свинца:
|