Эксклюзионная хроматография. Эксклюзионная хроматография (гель-хроматографии) – это особая форма жидкостной хроматографии, в которой разделение молекул основано на различии в их размерах
Эксклюзионная хроматография (гель-хроматографии) – это особая форма жидкостной хроматографии, в которой разделение молекул основано на различии в их размерах и частично в их форме. Гель-хроматография своим названием обязана тому, что в качестве носителя неподвижной фазы используют различные сетчатые полимеры («гели»), которые в зависимости от свойств матрицы можно разделить на мягкие, полужесткие и жесткие. Мягкие гели гидрофильны, поэтому при набухании они значительно увеличивают свой собственный объем. Процесс хроматографирования на мягких гелях называется гель-фильтрационной хроматографией. Полужесткие и жесткие гели в основном гидрофобны. Процесс хроматографирования на таких гелях называется гель-проникающей хроматографией. Мягкие гели используют для разделения больших молекул (обычно высокомолекулярных соединений), в то время как полужесткие – для разделения веществ с низкой молекулярной массой. Жесткие гели используются в основном в высокоэффективном варианте гель-хроматографии. Важной характеристикой гелей, от которой напрямую зависит способность разделения молекул, является диаметр пор. Поскольку создать гели с абсолютно идентичными по размерам порами практически невозможно, обычно гели характеризуют не одним размером пор, а распределением пор по размерам в определенном интервале, верхняя и нижняя границы которого составляют эксклюзионный диапазон. С диаметром пор связано такое понятие, как предел эксклюзии – значения относительных молекулярных масс, выше которых молекулы не удерживаются гелем. Данная величина зависит от диаметра пор геля и может принимать значения в диапазоне от 500 до нескольких миллионов. Следует отметить, что разделение в большей степени осуществляется за счет различий в размерах и форме молекул, нежели за счет разницы в молекулярных массах, но между этими характеристиками существует определенная корреляция. Перед использованием гели должны быть приведены в равновесное состояние (кондиционированы) путем контакта с подвижной фазой, которая будет применяться при дальнейшей работе. Этот процесс может занимать от нескольких часов до нескольких суток в зависимости от состава подвижной фазы. Неподвижной фазой в эксклюзионной хроматографии является элюент, находящийся в порах зёрен твёрдого носителя, подвижной фазой – этот же элюент, протекающий вдоль слоя частиц полимера. Выбор растворителя зависит от типа используемого геля, вида разделяемых веществ, применяемой системы детектирования. Например, для разделения веществ на гидрофильных гелях используют водные элюенты, в состав которых, как правило, входит буфер для контроля уровня рН. В случае гидрофобных гелей в качестве элюента используются неполярные органические растворители, такие как ТГФ, дихлорметан, толуол. Для детектирования в аналитической гель-хроматографии применяют рефрактометрический или фотометрический детекторы. Для высокомолекулярных веществ в качестве специального детектора может быть использован визкометр. В отличие от всех других методов жидкостной хроматографии, гель-хроматография не основана ни на каком-либо физическом или химическом взаимодействии с неподвижной фазой. Удерживание молекул определяется диффузией в поры геля и зависит как от размера молекул, так и от размера пор твердого носителя. В процессе хроматографирования молекулы, имеющие больший размер, чем максимальный диаметр пор набухшего геля, не способны проникать в его частицы и, следовательно, свободно проходят через колонку в пространстве между частицами. Меньшие же по размеру молекулы будут в различной степени проникать внутрь пор сорбента в зависимости от их размера и формы, причем, чем меньше размер молекул, тем больше вероятность этого проникновения. Следовательно, молекулы будут по-разному удерживаться в колонке и элюироваться в порядке уменьшения размеров (рис. 12). Рис. 12 Принцип эксклюзионной хроматографии Величина коэффициента распределения D в эксклюзионной хроматографии может находиться в пределах от 0 до 1. Данное утверждение справедливо лишь в тех случаях, когда на механизм распределения не накладываются другие взаимодействия, например, адсорбция или ионный обмен. Для крупных молекул, не способных проникать в поры геля, D = 0, следовательно, удерживаемый объём V R равен свободному объёму колонки V М. В случае молекул, размер которых позволяет им свободно диффундировать через пористый материал, D = 1 (поскольку состав подвижной и неподвижной фаз одинаков), следовательно, удерживаемый объём равен сумме свободного объёма колонки и объёма жидкости, находящейся в порах – V R = V М + V S. Для молекул промежуточного размера удерживаемый объем находится в интервале от V М до (V М + V S). Следовательно, методом гель-хроматографии можно разделить лишь те молекулы, размеры которых попадают в эксклюзионный диапазон. Для таких молекул значение коэффициента распределения больше нуля, но меньше единицы: 0 < D < 1. К преимуществам эксклюзионной хроамтографии относят то, что проба, как правило, не вступает ни в какие химические или физические взаимодействия, и поэтому ее компоненты элюируются без потерь. Кроме того, проба не влияет на разделяющую колонку, как это происходит в других видах жидкостной хроматографии. Недостатком же гель-хроматографии является узкий диапазон эксклюзии (значения D от 0 до 1) вследствие чего пиковая емкость ограничена. Поэтому для эффективного разделения в данном виде хроматографии приходится применять длинные колонки или несколько соединённых друг с другом колонок. Более того, не могут быть разделены вещества близкого размера, например, изомеры. Считается, что разделение может быть успешным только при различии молекулярных масс как минимум на 10%. Основное назначение гель-хроматографии – разделение смесей высокомолекулярных соединений (а также высокомолекулярных и низкомолекулярных) и определение молекулярно-массового распределения полимеров. Особое место занимает решение аналитических и препаративных задач биохимии, таких как очистка противовирусных препаратов.
4. Практическое применение ВЭЖХ Высокоэффективная жидкостная хроматография используется для разделения, в том числе и препаративного выделения, обнаружения и идентификации, а также количественного определения веществ различной химической природы (как полярных, так и неполярных, как ионов, так и молекул, как низкомолекулярных, так и высокомолекулярных).
В фармацевтическом анализе метод ВЭЖХ используется значительно чаще, чем метод газовой хроматографии. Это объясняется тем, что многие лекарственные вещества представляют собой сложные органические соединения, которые являются термолабильными (разрушаются при нагревании) или имеют низкую летучесть (характеризуются высокими температурами кипения). По чувствительности и селективности во многих случаях метод ВЭЖХ не уступает, а порой и превосходит методы газовой хроматографии. Основные области применения ВЭЖХ в фармацевтическом анализе: · идентификация лекарственных веществ, присутствующих в лекарственных формах; · определение примесей в лекарственных веществах (как в индивидуальных образцах, так и в лекарственных формах); · количественное определение лекарственных веществ, входящих в состав лекарственных форм (особенно в случае лекарственных форм сложного состава или при малом содержании определяемого компонента); · определение лекарственных веществ в биологических объектах. В настоящее время разработаны методики идентификации и количественного определения методом ВЭЖХ практически всех групп фармацевтических препаратов. Детектирование в большинстве случаев проводится с помощью фотометрических детекторов. Так, примерно 80% фармакопейных статей на лекарственные препараты включают для анализа именно этот метод.
5. Плоскостная хроматография Методы плоскостной хроматографии основаны на различии скоростей перемещения компонентов анализируемой смеси в плоском слое сорбента при движении растворителя (элюента). Различают бумажный и тонкослойный варианты плоскостной хроматографии. Как в БХ, так и в ТСХ разделение может быть обусловлено различными механизмами, например, адсорбционным, распределительным, ионообменным, ион-парным и др. Бумажная хроматография имеет ряд существенных недостатков и поэтому в настоящее время используется сравнительно редко: · процесс разделения зависит от состава и свойств бумаги; · содержание воды в порах бумаги может изменяться в зависимости от условий хранения; · очень низкая скорость хроматографирования (процесс получения хроматограммы может занимать нескольких суток); · низкая воспроизводимость результатов. 5.1. Тонкослойная хроматография Метод тонкослойной хроматографии (ТСХ), получивший в настоящее время широкое применение, был разработан Н. А. Измайловым и М. С. Шрайбер еще в 1938 г.
5.1.1. Неподвижные и подвижные фазы Хроматографическая пластинка представляет собой тонкую плоскую подложку, изготовленную из алюминиевой фольги, стекла или полимера (обычно полиэтиленгликольтерефталата), с нанесенным на нее вручную или промышленным способом сорбентом (неподвижной фазой). Для придания стабильности слоя сорбента на подложке используют различные связывающие вещества (гипс, крахмал, силиказоль, полиакриламид). Важной характеристикой сорбентов является диаметр их частиц. В классическом варианте ТСХ для производства пластинок используются частицы диаметром 11 – 20 мкм. В высокоэффективной тонкослойной хроматографии (ВЭТСХ) используют сорбенты, диаметр частиц которых составляет 5 – 7 мкм. Сравнительная характеристика пластинок для ТСХ и ВЭТСХ приведена в таблице 6.
Разделение на пластинах для ВЭТСХ получается более отчетливое и осуществляется за меньший промежуток времени. Недостатком таких пластин является значительно меньшая нагрузочная емкость. В качестве неподвижной фазы в методе ТСХ наиболее часто используют силикагель и его химически модифицированные производные: С18, -NH2, -CN и др. (аналогично ВЭЖХ), оксид алюминия, флорисил. Для ионообменного варианта тонкослойной хроматографии применяют пластинки на полимерной подложке, которые покрыты катионо- или анионообменными смолами. Особое место среди неподвижных фаз занимают импрегнированные различными веществами силикагели. Импрегнирование обычно проводят путем опрыскивания или погружения в раствор выбранного реагента, в качестве которых широко используются катионы различных металлов, борная кислота и др. В процессе хроматографического разделения эти соединения образуют различные по устойчивости комплексы с компонентами разделяемой смеси, что в сою очередь приводит к эффективности разделения. Для детектирования веществ, поглощающих в УФ области спектра, часто добавляют флуоресцентный индикатор (люминофор). В качестве подвижной фазы в методе ТСХ применяют либо индивидуальные растворители, либо их смеси, взятые в определённом соотношении. Подвижная фаза должна удовлетворять следующим требованиям: · не должна вступать в химические взаимодействия ни с разделяемыми компонентами, ни с неподвижной фазой; · быть малотоксичной и содержать минимум компонентов (результаты, получаемые при использовании многокомпонентных элюентов, как правило, трудно воспроизводимы); · должна быстро испаряться с поверхности хроматограммы; Подвижную фазу подбирают в соответствии со свойствами разделяемых веществ. Так полярные вещества следует разделять в полярных растворителях, малополярные – в менее полярных или неполярных растворителях. Для подавления диссоциации компонентов разделяемой смеси к подвижной фазе часто добавляют вещества кислого или основного характера.
Для характеристики полярности подвижной фазы в методе ТСХ используются те же характеристики (элюирующая сила и полярность), что и в колоночной хроматографии.
5.1.2. Методика получения плоскостной хроматограммы Методика получения плоскостных хроматограмм включает в себя следующие этапы: Œ Предварительный этап включает в себя подготовку пробы, подготовку пластины и подготовку хроматографической камеры и подвижной фазы. Подготовка пробы. Обычно пробу готовят растворением анализируемой смеси в подходящем растворителе с таким расчетом, чтобы приблизительная концентрация раствора получилась в диапазоне 0.1 – 1%. Если необходима очистка пробы, то используют различные методы разделения и концентрирования (жидкостная экстракция, твердофазная экстракция, осаждение, возгонка и др.). Если в дальнейшем планируется количественное определение разделяемых веществ, то все растворы должны готовиться строго количественно (точная навеска, точный объем). Подготовка пластины подразумевает: · промывку, которая проводится для удаления промышленных загрязнений (выполняется элюированием пустой пластины в применяемой системе растворителей или в нейтральном растворителе); · импрегнирование (если требуется по условиям анализа); · активацию сорбента путем нагрева пластинки в сушильном шкафу при температуре 100 – 105°С в течение часа (активированные пластинки затем хранят в вакуум-эксикаторах). Кроме того, перед нанесением пробы пластинку необходимо разделить на хроматографические зоны. Обычно на пластинке отражают линию «старта» с точками, на которые будут наноситься анализируемые пробы, и линию «фронта растворителя», до которой необходимо проводить элюирование. Количество проб, наносимых на пластинку, и высота линии «фронта растворителя» зависят от размера используемых пластин. Расстояние между пробами и расстояние от края пластинки до пробы желательно выдерживать не менее 1 см (для предотвращения смешивания проб или смыва проб с пластинки). Подготовка хроамтографической камеры и подвижной фазы. В качестве хроматографической камеры может выступать любой герметично закрывающийся сосуд. Перед использованием камеру насыщают парами элюента. Под насыщением хроматографической камеры понимается такое ее состояние, при котором все компоненты подвижной фазы находятся в динамическом равновесии со всеми компонентами газовой фазы как до элюирования хроматографической пластинки, так и во время элюирования. Если камеру не насытить парами элюента, то при хроматографировании по мере подъёма фронта элюента, будет происходить его частичное испарение. Причём легче будет испаряться тот растворитель в многокомпанентном элюенте, который хуже адсорбируется, и давление паров которого меньше. Т. е. в процессе подъема фронта элюента будет меняться состав подвижной фазы и, следовательно, хроматографические характеристики будут неверны. Время насыщения стандартной камеры (для пластинок 20 на 20 см) составляет приблизительно 2 – 2.5 часа в зависимости от состава подвижной фазы. Однако этот процесс можно существенно ускорить (до 0.5 – 1 часа), выложив внутренние стенки камеры фильтровальной бумагой, смоченной элюентом.
Нанесение исследуемой пробы на хроматографическую пластинку или бумагу проводят градуированным капилляром, микрошприцом или микропипеткой. В ВЭТСХ для нанесения пробы обычно используют платино-иридиевые капилляры, с помощью которых на пластинку наносится 100 – 200 нл. Кроме того, существуют автоматические раздаточные системы, позволяющие отмерять раствор пробы с высокой точностью. Капля наносится касанием капилляра или иглы поверхности пластинки (но не надавливанием, так как при этом можно повредить слой сорбента!). Оптимальное количество исследуемого вещества (объём раствора), наносимого на пластинку, обычно определяется экспериментально. Если наносимое количество вещества слишком мало, то его можно не заметить при последующем проявлении. Нанесение на пластинку слишком большого количества вещества приводит к перегрузке сорбента и, как следствие, размыванию пятна и уменьшению величины Rf. (рис. 13). Диаметр пятна на линии старта для ВЭТСХ не должен превышать 1 – 1.5 мм, а в случае классической ТСХ он может варьировать от 2 до 4 мм. ŽПосле нанесения исследуемых веществ на хроматографическую пластинку или бумагу, последние помещают в хроматографическую камеру и проводят хроматографирование. Уровень подвижной фазы в камере должен составлять не более половины от расстояния между нижним краем пластинки и линией «старта». Допускается ставить в камеру несколько пластинок, но оин при этом не должны соприкасаться. Все пластинки должны вноситься в камеру одновременно. После начала процесса хроматографирования недопустимо открывать крышку камеры, вытаскивать из камеры пластинки, перемещать камеру. Обычно процесс хроматографирования ведут до тех пор, пока растворитель не поднимется на расстояние ~10 см от линии старта. В зависимости от направления движения подвижной фазы различают следующие варианты плоскостной хроматографии (табл. 7).
После завершения процесса хроматографирования пластинку извлекают из хроматографической камеры и сушат. Высушенная пластинка представляет собой хроматограмму исследуемых веществ.
5.1.3 Анализ плоскостных хроматограмм Разделяемые вещества на пластинке или полоске бумаги образуют отдельные зоны (пятна), положение которых на хроматограмме характеризуют с помощью величины Rf – относительной скорости перемещения компонентов. Экспериментально величину Rf определяют как отношение расстояния, пройденного зоной вещества от стартовой линии до центра зоны (x), к расстоянию от стартовой линии до границы фронта растворителя к концу опыта (L):
В случае несимметричных пятен используют расстояние, пройденное до максимума интенсивности окраски. Согласно определению величина Rf может принимать значения от 0 до 1. Очевидно, что если Rf = 0, то вещество остаётся на старте, а если Rf = 1, то оно поднимается с фронтом растворителя. Величина Rf зависит от природы вещества, подвижной и неподвижной фазы, условий хроматографирования и, в определённых пределах, не зависит от концентрации вещества. Величина Rf является качественной хроматографической характеристикой вещества. Однако ее существенным недостатком является зависимость от большого количества факторов, не всегда поддающихся достаточному контролю. Поэтому на практике часто пользуются относительной величиной, равной отношению подвижности определяемого вещества и стандарта:
Величина R st может принимать значения как меньшие, так и большие 1. Стандартное вещество в том же растворителе наносится на стартовую линию рядом с анализируемой пробой, и, таким образом, хроматографируется в тех же условиях. Величина Rf связана с коэффициентом распределения вещества (D) и фактором удерживания неподвижной фазы по отношению к данному веществу (k) следующими уравнениями:
Для того чтобы оценить эффективность разделения в плоскостной хроматографии, измеряют расстояние от стартовой линии до нижнего края пятна данного вещества
Коэффициент разделения (a) и разрешение (R s) в плоскостной хроматографии рассчитывают следующим образом:
 ª ПРИМЕР.1 При хроматографировании аминазина (1) и дипразина (2) на хроматографической пластинке «Силуфол» при использовании в качестве подвижной фазы смеси ацетона и 0.25 М NaBr в объемном соотношении 1:1 были получены следующие результаты: расстояния от линии старта до центра пятен (1) и (2) соответственно равны 20.0 и 32.0 мм; диаметр пятен (1) и (2) – 4.0 и 3.0 мм; расстояние от линии старта до линии финиша – 100.0 мм. Рассчитайте значения Rf, k, N и Н для обоих веществ, а также величины коэффициента разделения и разрешения.
|


 Рис. 13 Изменение положения и формы пятна при увеличении количества вещества, нанесённого на пластинку
Рис. 13 Изменение положения и формы пятна при увеличении количества вещества, нанесённого на пластинку






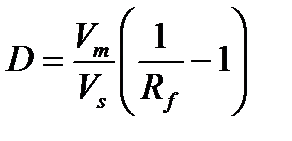 и
и 
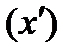 и расстояние от нижней до верхней границы этого пятна (w) – рис. 14. Число теоретических тарелок (N) и высоту эквивалентную теоретической тарелке (H) рассчитывают по формулам:
и расстояние от нижней до верхней границы этого пятна (w) – рис. 14. Число теоретических тарелок (N) и высоту эквивалентную теоретической тарелке (H) рассчитывают по формулам: и
и 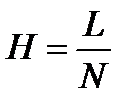
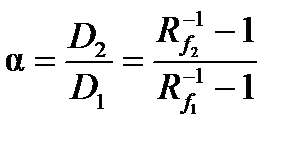 и
и 



