Розділ 1
Задачі рівня складності A
Яка термодинамічна система називається ізольованою? Ізольована система – система, яка не обмінюється енергією та речовиною з іншими системами
Що називається термодинамічною системою? Термодинамічна система – сукупність тіл (чи тіло), які можуть енергетично взаємодіяти між собою і з іншими тілами, а також обмінюватися з ними речовиною
Назвіть термічні параметри стану: Абсолютний тиск Р, абсолютна температура Т, питомий об’єм V
Назвіть калоричні параметри стану: Внутрішня енергія U, ентальпія H (I), ентропія S
Фізичний зміст універсальної газової сталої: універсальна газова стала R чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час нагрівання його на 1 К. Rµ = 8314 Дж/кмоль*К. Rµ = R*µ
Чому дорівнює питома газова стала для кисню?
Який буде абсолютний тиск газу в резервуарі, якщо надлишковий тиск 40656,5 Па а барометричний тиск 745 мм.рт.ст. Pa = Pб + Pн = 139965 Па
Який об’єм займає 1 кг повітря за нормальних фізичних умов? PV=mRT. V=
Яка густина азоту за нормальних умов? ρ =
Обчислити питому газову сталу кисню.
При яких умовах абсолютна температура може бути від’ємною? Абсолютна температура не може бути відємною. Т ≥ 0
В балоні міститься кисень масою 2 кг при тиску 8,3 МПа і температурі 18 0С. Обчислити місткість балона. PV=mRT. V=
Повітря масою 19,395 кг займає об’єм 15 м3. Чому дорівнює його питомий об’єм? υ =
Визначити абсолютний тиск пари в конденсаторі, якщо покази вакуумметра 620 мм.рт.ст. при 0 0C, а барометричний тиск становить 97309 Па при цій же температурі. Ра = Рб – Рв = 14663 Па
Визначити густину вуглекислого газу при тиску 101325 Па і температурі 0 0C. ρ = Pμ/RT. R вугл газу = 296.9
Задачі рівня складності B
Наскільки відрізняється питома газова стала водню від питомої газової сталої кисню?
Два кисневих балони однакового об’єму сполучені між собою трубою. Вичисліть абсолютний тиск який встановиться в обох балонах при t = 26 P=P1T/T1 = 4.93 МПа PI=P2T/T2 =8.16 МПа Pсер=(P+ PI)/2 = 6.55 МПа
Чому дорівнює молярна маса газу, якщо в посудині місткістю 1 л при температурі 15 PV=m(Rμ/μ)T. μ = 24.782 кг/моль
273 м3 ідеального газу нагрівається при сталому тиску від 546 до 547 К. Визначити на скільки зміниться об’єм газу. P=const. V1/T1 = V2/T2. V2 = V1* T2/ T1 = 273.5 V2 = 1.0018 V1
0,37·10-3 кг газоподібної органічної речовини при температурі 400 К і абсолютним тиском 0,0958 МПа займають об’єм 292·10-6 м3 . Встановіть хімічну формулу речовини PV = m(Rμ/μ)T. μ = mRμT/PV = 43.99 кг/моль
Резервуар місткістю 4 м3 наповнений діоксидом вуглецю (СО2). Обчислити масу газу, якщо надлишковий тиск газу в резервуарі 40 кПа, температурі 80 0С, а барометричний тиск 102,4 кПа. m = PVμ/ RμT. P = Pн + Pб μ(СО2) = 28
В балоні масою 117 кг і місткістю 100 л знаходиться кисень при температурі 20 0С. Визначити тиск кисню в балоні, якщо маса порожнього балону 102 кг. m(O2) = 15кг R = 259.8 P = mRT/V = 11418210 Па = 11.4 МПа
Обчислити масу випущеного повітря із балона, якщо місткість балона 200 л, початковий тиск в балоні 2,26 МПа, кінцевий 1,86 МПа. Початкова температура t1 = 99 оС. T2=T1P2/P2=306.16 K. μпов=29 m = PVμ/ RμT=4.238 кг
Визначити масу кисню в балоні об’ємом 56 л, якщо при 20 0C надлишковий тиск дорівнює 1,1 МПа, а атмосферний 740 мм.рт.ст.. P = Pн + Pа m = PVμ/ RμT= 0.882 кг
При автогенному різанні металу витрачається кисень із балона місткістю 50 л. Початковий абсолютний тиск кисню 12 МПа і температура 27 0C, кінцевий абсолютний тиск 6 МПа і температура 17 0C. Визначити витрату кисню. m1 = P1Vμ/ RμT1=7.698 кг m2 = P2Vμ/ RμT2=3.982 кг ∆m=m1 - m2=3.716 кг або ∆a=∆m/μ=0.116 кмоль або ∆V=∆a*V۫μ=2.598
В закритій посудині міститься повітря під тиском 750 мм.рт.ст. і температурі t1 = 20 0C. На скільки знизиться тиск в посудині, якщо його охолодити до t2 = -30 0C. P2=P1T2/T1 = 82.814 кПа
В резервуарі об’ємом 1 м3 міститься повітря при тиску 0,5 МПа і температурі 20 оС. Обчислити масу повітря: PV=m(Rμ/μ)T m = PVμ/ RμT = 2.976 кг
Задачі рівня складності C
Із резервуару місткістю 0,5 м3 в якому міститься кисень при абсолютному тиску 2,5 МПа і температурі 35 0С, випущено частину газу. Тиск в балоні знизився до 15 бар, а температура до 20 0С. Скільки випущено газу? m1 = P1Vμ/ RμT1=14.156 кг m2 = P2Vμ/ RμT2=8.929 кг ∆m=m1 - m2=5.227 кг або ∆a=∆m/μ=0.18 кмоль або ∆V=∆a*V۫μ=4.032
Яка кількість електричних ламп може бути заповнена азотом, який міститься в балоні об’ємом 4 м3 при абсолютному тиску 1 МПа і температурі t = 15 0С, якщо в колбі повинен бути абсолютний тиск p = 900 мм.рт.ст., при t =25 0С, а об’єм колби V = 100 см3. m1 = P1Vμ/ RμT1=46.775 кг m2 = P2Vμ/ RμT2=2.257 кг n= m1/m2= 20.72 ламп
|


 = 0.783
= 0.783 
 = 1.25
= 1.25 


 μ =28
μ =28 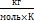 . тоді ρ = 35
. тоді ρ = 35 
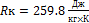 .
.  .
. 
 , якщо до сполучення параметри газу в першому балоні були р1 = 5 МПа і t1 = 30
, якщо до сполучення параметри газу в першому балоні були р1 = 5 МПа і t1 = 30  , а в другому р2 = 8,0 МПа і t2 = 20
, а в другому р2 = 8,0 МПа і t2 = 20 
 і тиску 0,2 МПа міститься 2,07 г газу?
і тиску 0,2 МПа міститься 2,07 г газу?



