Розділ 2
Задачі рівня складності A Чому дорівнює масова ізохорна теплоємність повітря у випадку незалежності її від температури? Cv=R/(k-1)= 955.63 Дж/кгК
Чому дорівнює теплоємність повітря при сталому об’ємі? масова ізобарна теплоємність повітря Сpm=22.4C¢pm/m кДж/(кг×К) Середня мольна ізобарна теплоємність повітря Сmpm=22.4C'pm кДж/ (кмоль×К)
Наскільки відрізняється теплоємність при сталому тиску від теплоємності при сталому об’ємі для аміаку? Cp = Cv + R R(NH3)=489 Cp = 489Cv
Для яких із названих газів залежність теплоємності від температури зображується лінією 1-2. Для двохатомних газів (Cx=C۫x+a+bT)
В якому термодинамічному процесі з участю ідеального газу теплоємність дорівнює нулю? При політропному процесі, але тільки якщо n=K
Чому дорівнює газова стала суміші з таким масовим складом µсум=1/∑(gi/µi)=29.41 R=Rµ/µ=289.7
Яке рівняння найточніше опише залежність теплоємності від температури для NH3 в інтервалі температур 0-1000 0С?
Як зміниться показник адіабати при збільшенні атомності газу? Спаде K=1.3 для багатоатомних
Як можна обчислити масову теплоємність ідеального газу при сталому тиску нехтуючи залежністю її від температури? Cx=δQ/mdT - масова теплоємніть
Від 5 кг газу відведено 5 кДж теплоти. На скільки змінилась температура газу, якщо його середня теплоємність 0,5 кДж/ (кг×К)? Cx=δQ/mdT dT= δQ/Cxm= 2 K
Визначити питомий об’єм суміші за нормальних фізичних умов, якщо заданий її масовий склад: 7 % N2; 8 % Н2; 70 % СН4; 5 % СО; і 10 % СО2. υ = 22.4/µ = 22.4/11.074= 2.0227
Генераторний газ має наступний масовий склад: Н2 = 7,0 %; СН4 = 2,0 %; СО = 27,6 %; СО2 = 4,8 %; N2 = 58,6 %. Визначити молекулярну масу суміші. µсум=1/∑(gi/µi)= 14.7 кг/кмоль
Повітря має такий об’ємний склад: 20,9 % кисню, 79,1 % азоту. Обчислити густину повітря за нормальних умов. µсум=∑(ri*µi) = 28.836 кг/кмоль ρ =
Обчислити молярну масу суміші яка складається із 5 кг СО2 і 3 кг Н2О. µсум=1/∑(gi/µi)= 28.57 кг/кмоль
Обчислити питому газову сталу суміші, яка складається із азоту з парціальним об’ємом 0,4 м3 і кисню, парціальний об’єм якого 0,2 м3. μі /μсум=Rсум/Rі μсум=μ1r1+μ2r2+...=29.3 Rсум = 283.75
Визначити молярну масу сухого повітря, якщо відомий його об’ємний склад – 21 % O2 і 79 % N2. μпов=μ1r1+μ2r2+...= 28.84
Чому дорівнює сума парціальних об’ємів газової суміші? Дорівнює обєму самої газової суміші (Vсум)
Перелічіть види теплоємності в залежності від температури Середня і істинна
Назвіть види теплоємності в залежності від термодинамічного процесу Ізобарна Cp та ізохорна Cv
Задачі рівня складності B
У скільки разів теплоємність при сталому тиску більша за теплоємність при сталому об’ємі для кисню? Більша на 259.8 (Cp = Cv + R)
Чому дорівнює молярна маса газової суміші з таким об’ємним складом µсум=∑(ri*µi) = 29.736 кг/кмоль
До газової суміші входить 11,1 %мас. водню і 89,9 %мас. кисню. Який її об’ємний склад? µсум=1/∑(gi/µi)= 11.96 кг/кмоль ri=gi µсум/ µi r1= 66.4 %; r2 = 33.6 %
Визначити питому газову сталу гримучого газу, який складається із 11,1 %мас. водню і 89,9 %мас. кисню: µсум=1/∑(gi/µi)= 11.96 кг/кмоль
Визначити густину газової суміші за норм. умов з таким об’ємним складом ρ =
Генераторний газ має наступний об’ємний склад, % об.: Н2 = 5,0; СН4 = 3,0; СО = 28,6; СО2 = 5,8; N2 = 57,6. Визначити масову частку СО: g(CO)=µi*ri/µсум = 0.29 µсум=∑(ri*µi) = 27.268 кг/кмоль
Об’ємний склад сухих продуктів згоряння палива (які не вміщують водяних парів) наступний СО2 =12,3%; О2 =7,2%; N2 =80,5%. Визначити їх густину за нормальних умов. ρ =
Аналіз продуктів згоряння палива показав наступний їх об’ємний склад: g(N2)=µi*ri/µсум = 0.74
Визначити газову постійну суміші, якщо об’ємний склад суміші наступний СО2 =12 %; СО =1 %; N2 = 74 %; Н2 = 13 %.
Визначити молярну частку водяної пари, якщо масовий склад суміші наступний: СО2 = 12 %; СО = 1 %; Н2О = 6 %; О2 = 7 %; Н2 = 74 %. µсум=1/∑(gi/µi)= 2.642 кг/кмоль y1=g1µсум/ µ1= 8.807 %
Аналіз продуктів згоряння палива показав наступний їх об’ємний склад: g(O2)=µi*ri/µсум = 0.086 = 8.6%
Визначити газову постійну суміші газів, яка складається з 1 м3 генераторного газу і 1,5 м3 повітря, взятих за нормальних умов. Густину генераторного газу PV = mRT R=PV/(V1 ρ1+V2 ρ2)T=301.86 Дж/кгК
В закритій посудині місткістю 0,1 м3 міститься кисень при 0 0С і тиску 760 мм.рт.ст. Визначити кількість теплоти яка потрібна для нагрівання кисню на 200 0С. Залежністю теплоємності від температури знехтувати. Q=mR(T2-T1)/k-1 m=PV/RT=0.143 кг Q=18575.7 Дж = 18.58 кДж
Газова суміш складається із діоксиду вуглецю, азоту, кисню, маси яких відповідно такі: 2 кг, 1 кг і 0,5 кг. Обчислити густину суміші при температурі 27 0С і тиску 147 кПа.
До якого тиску слід стиснути суміш масою 8 кг, яка складається із 18 % СО2, 12 % О2, 70 % N2 по масі, щоб при температурі 180 0С, вона займала об’єм 4 м3. P=mRT/V = 247374.24 Па = 0.247 МПа
Задачі рівня складності C Суміш містить 2,0 кг кисню і 8,0 кг водню. Чому дорівнює об’ємний склад суміші? µсум=1/∑(gi/µi)= 2.46 кг/кмоль ri=gi µсум/ µi r1= 1.6 %; r2 = 98.4 %
Знайти масу газової суміші, яка міститься кулястому газгольдері діаметром 5 м, якщо надлишковий тиск рн = 0,1 МПа, а барометричний тиск рб = 750 мм.рт.ст., темпе-ратура навколишнього середовища 20 0С. Склад газової суміші в %об.
m=PV/RT= 576.78 кг V=4ПRRR/3=65.42 µ=10.74 R=774.115
Гасова лампа спалює за годину 0,3 кг гасу, при цьому витрачається 5 кг повітря. Питома газова стала продуктів згорання, які утворюються при згорянні гасу 287 V=mRT/P= 9.8 м3 m=m1+m2=5.3
Визначити газову постійну суміші, яка складається із 20 масових часток повітря і 1 масової частки світильного газу. Густина світильного газу при 0 0C і 101325 Па дорівнює 0,52 кг/м3. R2=P/ ρT=713.76 µ2=R µ/R=11.648 µ1=29 µсум=1/∑(gi/µi)= 27.108 кг/кмоль Rзаг = 306.699
|

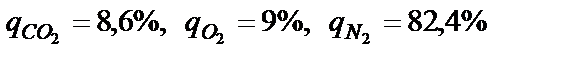 ?
?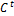 x=
x= 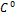 x+a+bT
x+a+bT
 = 1.287
= 1.287 
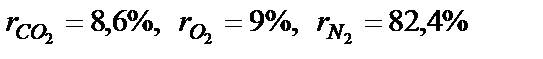 ?
?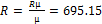
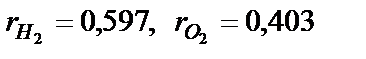
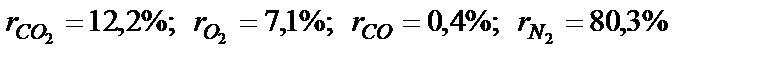 . Визначити масовий відсоток азоту.
. Визначити масовий відсоток азоту.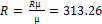 µсум=∑(ri*µi) = 26.54 кг/кмоль
µсум=∑(ri*µi) = 26.54 кг/кмоль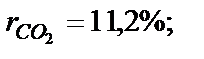
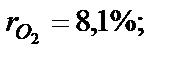
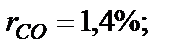
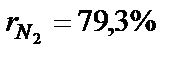 . Визначити масову частку кисню.
. Визначити масову частку кисню.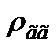 прийняти рівною 1,2 кг/м3.
прийняти рівною 1,2 кг/м3.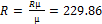 µсум=1/∑(gi/µi)= 36.17 кг/кмоль ρ = RT/P = 0.469
µсум=1/∑(gi/µi)= 36.17 кг/кмоль ρ = RT/P = 0.469 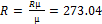 µсум=1/∑(gi/µi)= 30.45 кг/кмоль
µсум=1/∑(gi/µi)= 30.45 кг/кмоль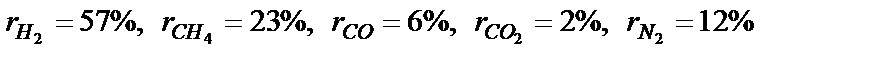 .
. . Температура продуктів згоряння 380 0C. Визначити об’єм продуктів згорання, які утворюються в лампі за годину, якщо барометричний тиск 101328 Па.
. Температура продуктів згоряння 380 0C. Визначити об’єм продуктів згорання, які утворюються в лампі за годину, якщо барометричний тиск 101328 Па.


