Правило произведения растворимости
В аналитической химии используются, помимо гомогенных систем, гетерогенные (неоднородные) системы, состоящие из двух и более фаз. Это касается прежде всего реакций осаждения, где существует равновесие между осадком, образующимся при осаждении, и раствором, соприкасающимся с осадком соответствующего вещества. Раствор, находящийся в динамическом равновесии с соответствующей твердой фазой, называется насыщенным раствором. В насыщенном растворе скорость растворения осадка, т. е. перехода ионов с поверхности твердой фазы в раствор, равна скорости противоположного процесса – осаждения растворенных ионов на поверхности. Равновесие малорастворимого соединения Me n An m с его насыщенным раствором, в котором он диссоциирует нацело*,
количественно может быть охарактеризовано константой равновесия
Активность твердого соединения
Полученная таким образом константа равновесия называется термодинамическим произведением растворимости, или произведением активности. В насыщенном растворе малорастворимого соединения произведение активностей ионов малорастворимого соединения в его насыщенном растворе в степенях, равных его стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением активности. Например:
Для весьма малорастворимых соединений (
Например:
Значения
Концентрация растворенного вещества в ненасыщенном растворе ниже, чем в насыщенном, а ионное произведение меньше произведения растворимости:
Наоборот, если ионное произведение превысит KS малорастворимого электролита, то процесс осаждения будет преобладать над процессом растворения и часть вещества выделится из раствора в твердую фазу. Для пересыщенного раствора BaSO4
Пользуясь правилом произведения растворимости, можно теоретически обосновать условия осаждения осадков, их растворимость и условия протекания других реакций в растворе. Можно предвидеть, произойдет ли выпадение осадка при смешении растворов заданной концентрации. Пример. Выпадет ли осадок BaSO4 при смешении равных объемов 0,02 М BaCl2 и 0,02 М Na2SO4? Решение. После смешения концентрация каждого иона за счет разбавления (объем увеличится в два раза) уменьшится в два раза и будет составлять Произведение их концентраций Таким образом, осадок малорастворимого электролита образуется только тогда, когда произведение концентраций ионов в степенях, равных стехиометрическим коэффициентам, превысит его произведение растворимости. Малорастворимый электролит будет осаждаться до тех пор, пока ионное произведение, постепенно уменьшаясь, не станет равным произведению растворимости осадка. Затем снова устанавливается равновесие между осадком и раствором, и осаждение прекращается. Известно, что не существует веществ, абсолютно не растворимых в воде. Поэтому при осаждении в растворе всегда остается какое-то количество ионов, отвечающих величине произведения растворимости. Если оно не очень велико (< 10 - 6 моль/л) и выполнению последующих аналитических реакций не мешает, то говорят, что достигнуто практически полное осаждение.
|

 (1.1)
(1.1) . (1.2)
. (1.2) постоянна, поэтому она может быть включена в константу:
постоянна, поэтому она может быть включена в константу: . (1.3)
. (1.3)
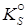 < 10-7) концентрации ионов в его насыщенном растворе очень малы и межионные силы практически не играют роли. Поэтому коэффициенты активности можно принять равными единице. В данном случае вместо активностей можно использовать равновесные концентрации ионов малорастворимого соединения в его насыщенном растворе, а вместо произведения активностей (
< 10-7) концентрации ионов в его насыщенном растворе очень малы и межионные силы практически не играют роли. Поэтому коэффициенты активности можно принять равными единице. В данном случае вместо активностей можно использовать равновесные концентрации ионов малорастворимого соединения в его насыщенном растворе, а вместо произведения активностей (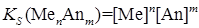 . (4.1.4)
. (4.1.4) .
. .
. .
.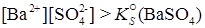 .
. моль/л.
моль/л.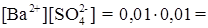
 . Это число намного превышает табличное значение
. Это число намного превышает табличное значение 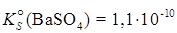 ; поэтому при смешении 0,02 М растворов BaCl2 и 0,02 М Na2SO4 осадок BaSO4 образуется.
; поэтому при смешении 0,02 М растворов BaCl2 и 0,02 М Na2SO4 осадок BaSO4 образуется.


