Влияние сильных электролитов на растворимость
Растворимость малорастворимого соединения существенным образом зависит от присутствия в растворе сильных электролитов, не имеющих общего иона с осадком и имеющего общий ион. Влияние сильного электролита, не имеющего общего иона с Присутствие сильного электролита, не имеющего с осадком одноименного иона, увеличивает растворимость за счет снижения активности ионов в растворе. Это явление получило название солевого эффекта. Пример. Вычислить растворимость AgCl в воде и в присутствии 0,05 М NH4 NO3. Решение. Растворимость AgCl в воде равна
В присутствии сильного электролита NH4NO3 (не имеющего общего иона с осадком) необходимо учитывать влияние на растворимость ионной силы раствора, создаваемую сильным электролитом 0,05 М NH4NO3. Концентрация
Из произведения активности для AgCl можно найти значение S:
Из приведенных расчетов видно, что, действительно, растворимость AgCl в присутствии 0,05 M NH 4NO3 возросла.
Влияние сильного электролита, имеющего общий ион с В присутствии сильного электролита, имеющего общий ион с осадком, растворимость осадка уменьшается вследствие увеличения концентрации одного из ионов малорастворимого соединения в растворе. В результате происходит дополнительное выпадение осадка, пока не наступит равновесие. Солевой эффект в данном случае также имеет место, однако вклад эффекта подавления растворимости является доминирующим. Пример. Вычислить растворимость AgCl в присутствии 0,05 М NH4Cl. Решение. При расчете растворимости надо учитывать тот факт, что концентрация Cl- - иона в растворе будет равна сумме концентрации (S + 0,05) за счет растворимости малорастворимого соединения ([Cl-]= S) и за счет диссоциации сильного электролита 0,05 М NH4Cl ([Cl- ] = 0,05 моль/л):
0,05 0,05 0,05
S S+0,05 Произведение растворимости для AgCl
т. к. S << 0,05,
Таким образом, приведенные расчеты показывают, что растворимость AgCl в присутствии NH4Cl существенным образом понижается по сравнению с растворимостью в воде (SAgCl =1,3. 10 -5 моль/л, см. предыдущий пример).
|

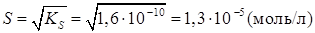 .
. :
: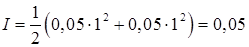 ;
; ;
; .
.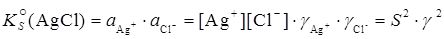 ;
; .
.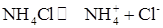
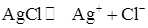
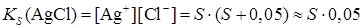 ;
;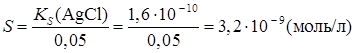 .
.


