Изменение pCl и при титровании 100 мл 0,1 н NaCl 0,1 н AgNO3
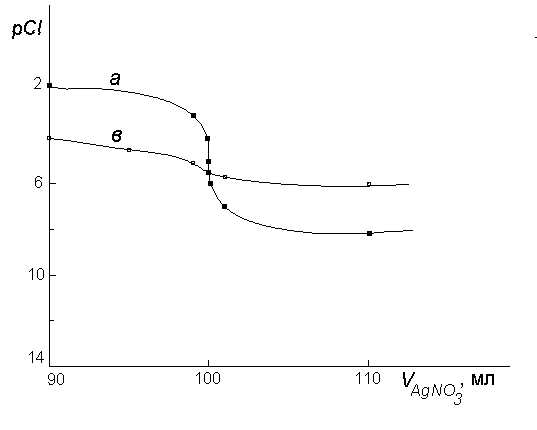
Рис.7.1. Кривая осадительного титрования: а- 0,1 н NaCl; в- 0,01 н NaCl
Рассчитанные значения pCl (или pAg) представлены в табл. 7.1, по данным которой построена кривая титрования (см. рис. 7.1). На кривой титрования вблизи точки эквивалентности наблюдается скачок в пределах pCl = 4 ¸6. Это позволяет применить для определения точки эквивалентности соответствующие химические индикаторы.
ЛИТЕРАТУРА Золотов Ю.А..Основы аналитической химии- М.: Высшая школа, ч.I.-2004-359с. Васильев В.П. Аналитическая химия. - М.: Высшая школа, ч.I. - 1989. - 320 с. Булатов М.И. Расчеты равновесий в аналитической химии. - Л.: Химия, 1984.- 194 с. Лурье Ю.Ю. Справочник по аналитической химии. - М.: Химия, 1989. - 448 с. Пилипенко А.Г., Пятницкий И.В. Аналитическая химия. - М.: Химия, ч.I. - 1990. - 480 с. Скуг Д., Уэст Д. Основы аналитической химии.- М.: Мир, 1979.-480 с. Цитович И.И. Курс аналитической химии. - М.: Высшая школа, 1994. - 495 с.
Вариант1 1.Вычислить растворимость PbJ2 в воде и 0.01М КJ. 2.Вычислить рН начала и конца осаждения Ca(ОН)2 из 0.01 М раствора 3.Рассчитать концентрации ионов серебра и хлорид-ионов в растворе после смешения 100 мл 0.1М раствора хлорида натрия с а) 99.9мл 0.1М раствора нитрата серебра; б) 100мл 0.1М раствора нитрата серебра 4.В 100 мл раствора содержится 1.64г нитрата кальция. Выпадет ли осадок при прибавлении к нему 100мл 0.1М раствора серной кислоты?
Вариант2 1.Рассчитать растворимость Cr(OH)2 и рН его насыщенного раствора. 2. Какая из двух сравниваемых солей более растворима: РbSO4 или PbCl2 ? 3.Рассчитать концентрации ионов серебра и хлорид ионов в растворе после смешения 10 мл 0.1М раствора хлорида натрия с а) 9.99мл 0.1М раствора нитрата серебра; б) 10.1мл 0.1М раствора нитрата серебра 4.Вычислить произведение растворимости CaCO3, если массовая концентрация насыщенного раствора соли составляет 6.9мг/л.
Вариант3 1.Рассчитать растворимость сульфата свинца в 0.1М растворе сульфата калия и 0.1М растворе хлорида калия. 2.Выпадет ли осадок при сливании равных объемом растворов нитрата свинца и фосфата аммония с концентрацией 10-6 М. 3.Вычислить рН начала конца осаждения Fe(OH)3 из 0.01 М раствора FeCl3. 4.В каком объеме воды растворится 10 мг PbCl2?
Вариант4 1.В насыщенном растворе какой из двух сравниваемых солей концентрация ионов серебра будет больше: AgCl или Ag2CrO4? 2.Вычислить рН начала конца осаждения Сr(OH)3 из 0.01 М раствора Сr(NO3)3. 3.Рассчитать концентрации ионов бария и сульфат ионов в растворе после смешения 20 мл 0.2М раствора хлорида бария с а) 39.99мл 0.1М раствора серной кислоты; б) 40.0 мл 0.1М раствора серной кислоты; 4.В каком объеме воды растворится 20 мг PbI2?
Вариант5 1.Вычислить растворимость Pb(OH)2 и рН его насыщенного раствора. 2.Выпадет ли осадок при сливании равных объемов 0.001М AgNO3 и 0.01М K3 AsO4? 3.Рассчитать рCl, рAg в точке эквивалентности при титровании раствора хлорида натрия нитратом серебра. 4.Сколько грамм сульфата бария содержится в 50 мл его насышенного раствора? Вариант6 1. В каком объеме воды растворится 200 мг BaSO4? 2.Какой ион будет осаждаться первым при постепенном добавлении раствора нитрата серебра к раствору, содержащему 0.01М SCN- и 0.01М I- ? 3.Рассчитать скачок на кривой титрования 20 мл 0.1М раствора KI 0.2М раством AgNO3. Погрешность определения 0.1%. 4.Рассчитать рН насыщенного раствора Co(OH)2.
Вариант7 1. Вычислить,как изменится растворимость оксалата кальция по сравнению с водой в 0.01М растворе оксалата калия? 2.Вычислить рН начала конца осаждения Со(OH)2 из 0.01 М раствора Со(NO3)2. 3.Рассчитать рSCN, рAg в точке эквивалентности при титровании раствора нитрата серебра раствором роданида аммония. 4.Сколько грамм оксалата бария содержится в 100 мл его насышенного раствора?
Вариант8 1.Вычислить потери от растворимости при промывании 187.8 мг AgBr 100мл дистиллированной воды. 2.Выпадет ли осадок при сливании 200мл 0.001М раствора нитрата свинца и 300 мл раствора KI c Т=0.001660 г/мл? 3.Рассчитать скачок на кривой титрования 20 мл 0.1М раствора нитрата серебра 0.2М раствором роданида аммония. Погрешность определения 0.1%. 4.Рассчитать рН насыщенного раствора Mn(OH)2?
Вариант9 1.Вычислить растворимость Ag2CO3 в 0.1М растворе К2CO3 и 0.1М растворе KCl. 2.В насыщенном растворе какого из двух гидроксидов концентрация ионов железа будет большей: Fe(OH)2 или Fe(OH)3?Подтвердите расчетом. 3.Рассчитать концентрации ионов Ag + и CrO42- в растворе после сливания равных объемов 0.1М растворов AgNO3 и K2CrO4. 4.Вычислить рН начала и конца осаждения Mn(OH)2 из 0.01 М раствора Mn(NO3)2.
Вариант10 1.Как изменится растворимость PbCrO4 в 0.1М растворе K2CrO4 по сравнению с растворимостью в дистиллированной воде? 2. Вычислить рН начала и конца осаждения Ni(OH)2 из 0.01 М раствора Ni(NO3)2. 3.Рассчитать концентрации ионов серебра и роданид ионов в растворе после смешения 20 мл 0.2М раствора нитрата серебра с а) 39.99мл 0.1М раствора роданида калия; б) 40.0 мл 0.1М раствора роданида калия. 4.Сколько грамм AgI содержится 25 мл его насыщенного раствора?
Вариант11 1.В насыщенном растворе какой из двух сравниваемых солей концентрация ионов серебра будет большей: AgI или Ag3PO4? Подтвердите расчетом. 2.Выпадет ли осадок при сливании 200мл 0.001М раствора хлорида кальция и 300 мл раствора Na2CO3 c Т=0.001660 г/мл? 3. Вычислить произведение растворимости AgNO2,если массовая концентрация насыщенного раствора соли составляет 4.15 г/мл. 4.Рассчитать массу CI- в 100 мл насыщенного раствора AgCI.
Вариант12 1.Рассчитать массовую концентрацию (г/л) PbCrO4 в насышенном растворе этой соли. 2. В 100мл раствора содержится 1 г Na2CO3. Выпадет ли осадок при приливании 100мл 0.01М раствора нитрата свинца? 3.Рассчитать концентрации ионов марганца и сульфид ионов в растворе после сливания 20 мл 0.2М раствора нитрата марганца с а) 39.99мл 0.1М раствора сульфида калия; б) 40.0 мл 0.1М раствора сульфида калия. 4.В каком объеме растворится 100 мг PbI2?
Вариант13 1.Вычислить потерю от растворимости при промывании 200мл воды 100мг осадка СаCO3.. 2.Выпадет ли осадок при сливании 200мл 0.001М раствора нитрата бария и 200 мл 0.01М раствора оксалата калия? 3.Рассчитать концентрации ионов свинца и сульфат ионов в растворе после сливания 20 мл 0.2М раствора нитрата свинца с а) 19.9мл 0.2М раствора серной кислоты; б) 41.0 мл 0.1М раствора серной кислоты. 4.Массовая концентрация соли в насыщенном растворе BaCrO4 составляет 3.5 мг/л. Вычислить произведение растворимости этой соли.
Вариант14 1.В насыщенном растворе какой из двух сравниваемых солей концентрация сульфид ионов будет больше: Ag 2S или FeS? Подтвердите расчетом. 2.Вычислить рН начала конца осаждения Mn(OH)2 из 0.01 М раствора Mn(NO3)2. 3.Массовая концентрация соли в насыщенном растворе CaSO4 составляет 2г/л. Насыщенный раствор CaSO4 смешивают с равным объемом раствора (NH4)2C2O4, содержащим 0.0248 г этой соли в 1 литре. Определить, образуется ли осадок СаC2O4? 4.Как изменится растворимость ВаCO3. в присутствии 0.01М раствора К 2CO3?
Вариант15 1.Какой ион будет осаждаться первым при постепенном добавлении раствора сульфата аммония к раствору, содержащему 20 г/л ионов бария и 500 г/л ионов свинца? 2.Вычислить рН начала конца осаждения Pb(OH)2 из 0.005 М раствора Pb(NO3)2 3.Рассчитать концентрации ионов серебра и фторид ионов в растворе после сливания равных объемов 0.1М растворов нитрата серебра и фторида калия. 4.Вычислить потерю массы осадка AgCI при промывании его 100мл воды.
Вариант16 1.Как повлияет на растворимость СаC2O4 присутствие 0.1М раствора KCI? Подтвердите расчетом. 2.Выпадет ли осадок при сливании 200мл 0.001М раствора нитрата бария и 200 мл 0.01М раствора сульфата калия? 3.Для насыщения 200 мл воды требуется 0.71 мг BaCrO4. Вычислить произведение растворимости BaCrO4 4.В каком объеме воды можно растворить 0.01мг AgCI?
Вариант17 1. Рассчитать массу ионов серебра в 100 мл насыщенного раствора AgI. 2. На раствор, содержащий хлорид и иодид ионы. действуют 0.01М раствором нитрата серебра. Какой осадок AgCI или AgI, образуются в первую очередь, если концентрации этих анионов были равны 0.01моль/л. 3.Как повлияет на растворимость сульфата свинца присутствие 0.1М раствора сульфата калия? Подтвердите расчетом. 4.В каком объеме воды можно растворить 0.01мг AgI?
Вариант18 1.В250 мл раствора содержится по 1 г нитрата кальция и нитрата стронция. Какой осадок выпадет первым из раствора от прибавления к нему 1 мл 5М раствора серной кислоты? 2.Рассчитать массу Pb2+ в 200мл насыщенного раствора PbCI2. 3.Рассчитать скачок на кривой титрования 20 мл 0.1н раствора нитрата серебра 0.2н раствором роданида аммония. Погрешность определения 0.1%. 4.Вычислить произведение растворимости сульфата свинца. если массовая концентрация насыщенного раствора соли составляет 4.9×10-2 г/мл.
Вариант 19 1. В насыщенном растворе какой из двух сравниваемых солей концентрация фторид ионов будет больше: Ag F или CaF2? Подтвердите расчетом 2. Рассчитать концентрации ионов кальция и сульфат ионов в растворе после сливания 100 мл раствора, содержащего 1.64г нитрата кальция с 50мл 0.1М раствора серной кислоты. 3. Рассчитать скачок на кривой титрования 20 мл 0.1н раствора нитрата серебра 0.1н раствором роданида аммония. Погрешность определения 0.2%. 4. Как повлияет на растворимость AgI присутствие 0.01М раствора KI? Подтвердите расчетом.
Вариант 20 1.Для насыщения 200мл воды требуется 0.71 г BaCrO4. Рассчитать произведение растворимости BaCrO4. 2.Смешали равные объемы 0.001М растворов KCI и AgNO3. Образуется ли осадок? 3. Рассчитать концентрации ионов бария и сульфат ионов в растворе после сливания 10 мл раствора нитрата бария с Т=0.02613г/мл с 9.99мл 0.1М раствора серной кислоты. 4. Как повлияет на растворимость AgВr присутствие 0.02М раствора KBr? Подтвердите расчетом. Вариант 21 1.Рассчитать массу CdCO3 в 250 мл его насыщенного раствора. 2.Какой катион будет осаждаться первым при постепенном добавлении раствора сульфата аммония к раствору. содержащему 0.1моль/л бария и свинца? 3.Вычислить рН насыщенного раствора Ca(OH)2. 4.Вычислить растворимость сульфата бария в 0.1М растворе KCI и 0.1М K2SO4.
Вариант 22 1.Рассчитать массу CиCO3 в 200 мл его насыщенного раствора. 2.На раствор, содержащий CI- и I- действуют 0.01М раствором нитрата серебра. Какой осадок образуется в первую очередь, если концентрации этих анионов были равны 0.1моль/л. 3.Рассчитать скачок на кривой титрования 20мл 0.1н раствора КI 0.1н раствором нитрата серебра. Погрешность определения 0.2%. 4.Вычислить произведение растворимости BaSO4, если массовая концентрация насыщенного раствора соли составляет 2.8×10-3 г/л.
Вариант 23 1.Вычислить произведение растворимости CaF2, если массовая концентрация насыщенного раствора соли составляет 17мг/л. 2.Может ли образоваться осадок PbCrO4 в растворе, содержащем в100мл 0.001моль нитрата свинца и 0.002 моль хромата калия? 3.В каком объеме воды растворится 5 мг PbI2? 4..Рассчитать растворимость CaCO3 в 0.01М К 2CO3 и сравнить ее с растворимостью в чистой воде.
Вариант 24 1.Вычислить растворимость PbI2 в воде и 0.02М NaI. 2.Вычислить рН начала и конца осаждения Са(ОН)2 из 0.01 М раствора Са(NO3)2. 3.Рассчитать концентрации ионов серебра и хлорид-ионов в растворе после смешения 100 мл 0.1М раствора хлорида натрия с а) 100.9мл 0.1М раствора нитрата серебра; б) 100мл 0.1М раствора нитрата серебра 4.В 100 мл раствора содержится 1.64г нитрата кальция. Выпадет ли осадок при прибавлении к нему 10.0мл 0.2М раствора серной кислоты?
Вариант25 1.Рассчитать растворимость Cr(OH)2 и рН его насыщенного раствора. 2. Какая из двух сравниваемых солей более растворима: РbSO4 или PbS? 3.Рассчитать концентрации ионов серебра и хлорид ионов в растворе после смешения 10 мл 0.1М раствора хлорида натрия с а)19.99мл 0.05М раствора нитрата серебра; б) 100.1мл 0.01М раствора нитрата серебра 4.Вычислить произведение растворимости CaCO3, если массовая концентрация насыщенного раствора соли составляет 6.9мг/л.
Вариант26 1.Рассчитать растворимость сульфата свинца в 0.01М растворе сульфата калия и 0.01М растворе хлорида натрия. 2.Выпадет ли осадок при сливании равных объемом растворов нитрата свинца и фосфата аммония с концентрацией 10-4М. 3.Вычислить рН начала и конца осаждения Fe(OH)3 из 0.02 М раствора FeCl3. 4.В каком объеме воды растворится 5 мг PbF2?
Вариант27 1.В насыщенном растворе какой из двух сравниваемых солей концентрация ионов серебра будет больше: AgCl или Ag I? 2.Вычислить рН начала конца осаждения Сr(OH)3 из 0.02 М раствора Сr(NO3)3. 3.Рассчитать концентрации ионов бария и сульфат ионов в растворе после смешения 20 мл 0.2М раствора хлорида бария с а) 19.99мл 0.2М раствора серной кислоты; б) 40.0 мл 0.1М раствора серной кислоты; 4.В каком объеме воды растворится 10 мг PbI2? Вариант28 1.Вычислить растворимость Pb(OH)2 и рН его насыщенного раствора. 2.Выпадет ли осадок при сливании равных объемов 0.02М AgNO3 и 0.01М K3 AsO4? 3.Рассчитать рCl, рAg в точке эквивалентности при титровании раствора хлорида натрия нитратом серебра. 4.Сколько грамм сульфата бария содержится в 10 мл его насыщенного раствора?
Вариант29 1.В каком объеме воды растворится 100 мг BaSO4? 2.Какой ион будет осаждаться первым при постепенном добавлении раствора нитрата серебра к раствору, содержащему 0.001М SCN- и 0.001М СI- ? 3.Рассчитать скачок на кривой титрования 20 мл 0.2М раствора KI 0.2М раствором AgNO3. Погрешность определения 0.2%. 4.Рассчитать рН насыщенного раствора Co(OH)2.
Вариант30 1. Вычислить, как изменится растворимость оксалата кальция по сравнению с водой в 0.02М растворе оксалата калия? 2.Вычислить рН начала конца осаждения Со(OH)2 из 0.001 М раствора Со(NO3)2. 3. Рассчитать рSCN, рAg в точке эквивалентности при титровании раствора нитрата серебра раствором роданида аммония. 4.Сколько грамм оксалата меди содержится в 10 мл его насыщенного раствора?
Вариант31 1.Вычислить потери от растворимости при промывании 187.8 мг AgBr 50мл дистиллированной воды. 2.Выпадет ли осадок при сливании 100мл 0.002М раствора нитрата свинца и 300 мл раствора KI c Т=0.001660 г/мл? 3.Рассчитать скачок на кривой титрования 20 мл 0.1М раствора нитрата серебра 0.1М раствором роданида аммония. Погрешность определения 0.2%. 4.Рассчитать рН насыщенного раствора Mn(OH)2? Вариант 32 1.Вычислить растворимость Ag2CO3 в 0.01М растворе К2CO3 и 0.01М растворе KCl. 2.В насыщенном растворе какого из двух гидроксидов концентрация ионов железа будет большей: Fe(OH)2 или Fe(OH)3? Подтвердите расчетом. 3.Рассчитать концентрации ионов серебра и роданид ионов в растворе после смешения 20 мл 0.2М раствора нитрата серебра с а) 39.99мл 0.1М раствора роданида калия; б) 41.0 мл 0.1М раствора роданида калия. 4.Вычислить рН начала и конца осаждения Mn(OH)2 из 0.02 М раствора Mn(NO3)2.
Вариант33 1.Как изменится растворимость PbCrO4 в 0.01М растворе K2CrO4 по сравнению с растворимостью в дистиллированной воде? 2. Вычислить рН начала и конца осаждения Ni(OH)2 из 0.02 М раствора Ni(NO3)2. 3. Рассчитать концентрации ионов Ag + и CrO42- в растворе после сливания равных объемов 0.1М растворов AgNO3 и K2CrO4. 4.Сколько грамм AgI содержится 50 мл его насыщенного раствора?
Вариант34 1.В насыщенном растворе какой из двух сравниваемых солей концентрация ионов серебра будет большей: AgI или Ag3PO4? Подтвердите расчетом. 2.Выпадет ли осадок при сливании 100мл 0.001М раствора хлорида кальция и 200 мл раствора Na2CO3 c Т=0.001660 г/мл? 3. Вычислить произведение растворимости AgNO2, если массовая концентрация насыщенного раствора соли составляет 4.15 г/мл. 4. В каком объеме растворится 50 мг PbI2?
Вариант35 1.Рассчитать массовую концентрацию (г/л) PbCrO4 в насыщенном растворе этой соли. 2. В 200мл раствора содержится 2 г Na2CO3..Выпадет ли осадок при приливании 200мл 0.02М раствора нитрата свинца? 3.Рассчитать концентрации ионов марганца и сульфид ионов в растворе после сливания 20 мл 0.2М раствора нитрата марганца с а) 39.99мл 0.1М раствора сульфида калия; б) 41.0 мл 0.1М раствора сульфида калия. 4.Рассчитать массу CI- в 50 мл насыщенного раствора AgCI
Вариант36 1.Вычислить потерю от растворимости при промывании 100мл воды 100мг осадка СаCO3.. 2.Выпадет ли осадок при сливании 200мл 0.01М раствора нитрата бария и 200 мл 0.02М раствора оксалата калия? 3.Рассчитать концентрации ионов свинца и сульфат ионов в растворе после сливания 20 мл 0.2М раствора нитрата свинца с а) 19.9мл 0.2М раствора серной кислоты; б) 41.0 мл 0.1М раствора серной кислоты. 4. Как изменится растворимость ВаCO3. в присутствии 0.02М раствора Na 2CO3?
Вариант37 1.В насыщенном растворе какой из двух сравниваемых солей концентрация сульфид ионов будет больше: Ag 2S или FeS? Подтвердите расчетом. 2.Вычислить рН начала конца осаждения Mn(OH)2 из 0.02 М раствора Mn(NO3)2. 3.Массовая концентрация соли в насыщенном растворе CaSO4 составляет 2г/л. Насыщенный раствор CaSO4 смешивают с равным объемом раствора (NH4)2C2O4, содержащим 0.0248 г этой соли в 1 литре. Определить, образуется ли осадок СаC2O4? 4. Массовая концентрация соли в насыщенном растворе BaCrO4 составляет 3.5 мг/л. Вычислить произведение растворимости этой соли.
Вариант38 1.Какой ион будет осаждаться первым при постепенном добавлении раствора сульфата аммония к раствору, содержащему 10 г/л ионов бария и 250 г/л ионов свинца? 2.Вычислить рН начала конца осаждения Pb(OH)2 из 0.001 М раствора Pb(NO3)2 3.Рассчитать концентрации ионов серебра и фторид ионов в растворе после сливания равных объемов 0,01М растворов нитрата серебра и фторида калия. 4.Вычислить потерю массы осадка AgCI при промывании его 100мл воды.
Вариант39 1.Как повлияет на растворимость СаC2O4 присутствие 0.01М раствора KCI? Подтвердите расчетом. 2.Выпадет ли осадок при сливании 100мл 0.002М раствора нитрата бария и 100 мл 0.02М раствора сульфата калия? 3. Для насыщения 200 мл воды требуется 0.71 мг BaCrO4. Вычислить произведение растворимости BaCrO4 4. Рассчитать массу ионов серебра в 100 мл насыщенного раствора AgI.
Вариант40 1. В каком объеме воды можно растворить 0.01мг AgCI? 2. На раствор, содержащий хлорид и иодид ионы. действуют 0.01М раствором нитрата серебра. Какой осадок AgCI или AgI, образуются в первую очередь, если концентрации этих анионов были равны 0.01моль/л. 3.Как повлияет на растворимость сульфата свинца присутствие 0.1М раствора сульфата калия? Подтвердите расчетом. 4.
Вариант41 Вычислить произведение растворимости сульфата свинца. если массовая концентрация насыщенного раствора соли составляет 4.9×10-2 г/мл. 1.В 250 мл раствора содержится по 1 г нитрата кальция и нитрата стронция. Какой осадок выпадет первым из раствора от прибавления к нему 10 мл 0. 5М раствора серной кислоты? 2.Рассчитать массу Pb2+ в 200мл насыщенного раствора PbCI2. 3.Рассчитать скачок на кривой титрования 20 мл 0.1н раствора нитрата серебра 0.2н раствором роданида аммония. Погрешность определения 0.1%. 4. В каком объеме воды можно растворить 0.01мг AgI?
Вариант 42 1.В насыщенном растворе какой из двух сравниваемых солей концентрация фторид ионов будет больше: Ag F или CaF2? Подтвердите расчетом 2.Рассчитать концентрации ионов кальция и сульфат ионов в растворе после сливания 100 мл раствора, содержащего 1.64г нитрата кальция с 100мл 0.01М раствора серной кислоты. 3.Рассчитать скачок на кривой титрования 20 мл 0.1н раствора нитрата серебра 0.2н раствором роданида аммония. Погрешность определения 0.2%. 4.Как повлияет на растворимость AgI присутствие 0.02М раствора KI? Подтвердите расчетом.
Вариант 43 1.Для насыщения 200мл воды требуется 0.71 г BaCrO4. Рассчитать произведение растворимости BaCrO4. 2.Смешали равные объемы 0.01М растворов KCI и AgNO3. Образуется ли осадок? 3. Рассчитать концентрации ионов бария и сульфат ионов в растворе после сливания 20 мл раствора нитрата бария с Т=0.02613г/мл с 9.99мл 0.1М раствора серной кислоты. 4. Как повлияет на растворимость AgВr присутствие 0.002М раствора KBr?Подтвердите расчетом. Вариант 44 1.Рассчитать массу соли CdCO3 в 50 мл его насыщенного раствора. 2.Какой катион будет осаждаться первым при постепенном добавлении раствора сульфата аммония к раствору. содержащему 0.01моль/л бария и свинца? 3.Вычислить рН насыщенного раствора Ca(OH)2. 4.Вычислить растворимость сульфата бария в 0.01М растворе KCI и 0.01М Na2SO4.
Вариант 45 1.Рассчитать массу соли CиCO3 в 100 мл его насыщенного раствора. 2.На раствор, содержащий CI- и I- действуют 0.02М раствором нитрата серебра. Какой осадок образуется в первую очередь, если концентрации этих анионов были равны 0.01моль/л. 3.Рассчитать скачок на кривой титрования 20мл 0.1н раствора КI 0.2н раствором нитрата серебра. Погрешность определения 0.2%. 4.Вычислить произведение растворимости BaSO4, если массовая концентрация насыщенного раствора соли составляет 2.8×10-3 г/л.
Вариант 46 1.Вычислить произведение растворимости CaF2, если массовая концентрация насыщенного раствора соли составляет 17мг/л. 2.Может ли образоваться осадок PbCrO4 в растворе, содержащем в200мл 0.002моль нитрата свинца и 0.001 моль хромата калия? 3.В каком объеме воды растворится 15 мг PbI2? 4..Рассчитать растворимость CaCO3 в 0.001М К 2CO3 и сравнить ее с растворимостью в чистой воде.
|



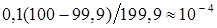


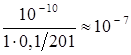

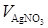 , мл
, мл
 . (7.5)
. (7.5)


