Тема 14. Гетерогенные равновесия и процессы. Произведение растворимости.
По растворимости все вещества можно классифицировать следующим образом:
Растворимость вещества зависит от природы растворяемого вещества, температуры, концентрации ионов в растворе. В зависимости от содержания растворенного вещества и соотношения скоростей процессов растворения и кристаллизации различают насыщенные, ненасыщенные и пересыщенные растворы. Насыщенным называется раствор, находящийся в равновесии с осадком растворяемого вещества, при этом скорость растворения вещества равна скорости его кристаллизации. Насыщенный раствор содержит максимально возможное при данных условиях (температуре) количество растворенного вещества. Ненасыщенным называется раствор, в котором можно растворить при тех же условиях дополнительное количество растворяемого вещества, т.е. скорость растворения вещества больше скорости его кристаллизации. Пересыщенным называется термодинамически неустойчивая система, в которой скорость растворения вещества меньше скорости его кристаллизации. При растворении большинства солей в воде в раствор переходят не молекулы, а ионы. Поэтому в водном насыщенном растворе малорастворимого сильного электролита между твердой фазой (осадком) и ионами этого электролита в водной фазе устанавливается динамическое гетерогенное равновесие. Рассмотрим гетерогенное равновесие между кристаллическим осадком малорастворимой соли AgCI и его водным раствором, содержащим ионы Ag+ и CI-. При введении в воду соли в количестве, большем, чем это необходимо для получения насыщенного раствора, будет иметь место равновесие между твердой фазой и ионами соли в растворе: (AgCI)тв. Û; (AgCI)растÛ Ag+ + CI_ , для AgCI можно записать константу равновесия: [Ag+ ] [Cl- ] K = ----------- [AgCl] Так как концентрация твердого вещества [AgCl] постоянна, можно умножить константу равновесия и [AgCl] получить новую постоянную величину, которую называют произведением растворимости (ПР) ПР(AgCI) =[Ag]*[CI] а в общем виде для любого труднорастворимого электролита: В насыщенном растворе соли произведение молярных концентраций ее ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре, называемая произведением растворимости (ПР). Ионное произведение (ИП) – это произведение реальных концентраций ионов труднорастворимых солей в растворах различных типов (ненасыщенном, насыщенном или пересыщенном). ИП = ПР насыщенный раствор ИП < ПР ненасыщенный раствор (растворение осадка) ИП > ПР пересыщенный раствор (выпадение осадка) Гетерогенные равновесия и организм В организме человека в норме важнейшими гетерогенными процессами являются образование костной ткани. Ее основной компонент – гидроксиапатит Ca10(PO4)6(OH)2. гидроксифосфат кальция Са5(ОН)(Р04)з Его образование можно выразить общей схемой:
Формирование костной ткани начинается с плазмы крови. В плазме содержатся необходимые для этого катионы кальция, а также дигидро- и гидрофосфат-ионы. Этих концентраций достаточно для образования осадка СаНР04. Так как раствор лишь слегка пересыщен, в плазме кристаллизация приводит к образованию малых количеств микрокристаллов гидрофосфата кальция. В клетках костной ткани (остеобластах), в результате ферментативного гидролиза увеличивается концентрация фосфат-ионов, что способствует превращению гидрофосфата кальция в гидроксиапатит. Этому же благоприятствует и слабощелочная среда плазмы. При увеличении концентраций свободных ионов кальция и гидрофосфат-ионов в плазме происходит отложение гидроксиапатита в костной ткани. У взрослого человека полная перестройка костной ткани осуществляется примерно каждые 10 лет. Регуляция концентрации ионов кальция в плазме. Поддержание концентрации ионов кальция на постоянном уровне (2,25 – 2,75 ммоль/л) обеспечивают костная ткань и плазма крови, содержащая фосфат-ионы; эту систему можно рассматривать как кальциевый буфер. Функционирование этого буфера регулируется гормонально
|

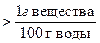
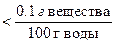 растворимые малорастворимые нерастворимые
растворимые малорастворимые нерастворимые




