Разделение цинка и никеля
В стакан емкостью 100мл помещают смесь из 1,5–3 мл 0,25 М раствора ZnSO4и 1,5–3мл 0,25 М раствора NiSO4. К анализируемому раствору добавляют 5 мл 6 М раствора HCl, при этом катионы цинка образуют хлоридные комплексные анионы [ZnCl3]–. Полученный раствор пропускают со скоростью 1 капля в 1 секунду через колонку с анионитом АВ-17 в Сl – -форме.Вытекающий из колонки раствор, содержащий ионы никеля, собирают в коническую колбу емкостью 250мл. Для полного вымывания из анионита ионов никеля через колонку пропускают отдельными порциями по 10-15 мл около 100мл 2М раствора HCl. Для извлечения ионов цинка анионит промывают 100мл дистиллированной воды со скоростью 2 капли в 1 секунду. Промывание проводят отдельными порциями по 10–15 мл дистиллированной воды так, чтобы каждая новая порция прибавлялась только после полного вытекания предыдущей. Элюат, содержащий ионы цинка, собирают в другую коническую колбу емкостью 250мл. Следует помнить, что над слоем анионита всегда должна находиться жидкость. 2. Определение никеля Содержание ионов никеля в солянокислом растворе определяют комплексонометрическим методом. Для этого в коническую колбу с ионами никеля добавляют 50 мл дистиллированной воды, 10 мл 6М раствора NaOH и по каплям 12 % NH4OH до изменения окраски красной лакмусовой бумаги в серо-голубой цвет (красную лакмусовую бумагу помещают в раствор и, не вынимая ее, следят за изменением цвета). После этого добавляют щепотку индикатора мурексида и титруют трилоном Б до перехода желтой окраски раствора в фиолетовую. Содержание никеля определяют по формуле:
где С – молярная концентрация эквивалента трилона Б, моль-экв/л; V – объем трилона Б, израсходованный на титрование, мл; m (Ni2+) – масса никеля в исследуемом растворе, г
|

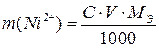 (2.21),
(2.21),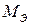 (Ni2+) – молярная масса эквивалента никеля в данной реакции, г/моль-экв;
(Ni2+) – молярная масса эквивалента никеля в данной реакции, г/моль-экв;


