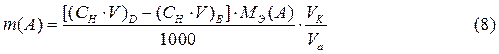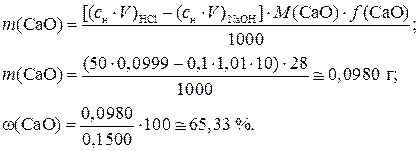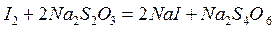Пример 2.
Рассчитать, какой объем 3 н H2SO4 следует прибавить к 1 л 0,6 нH2SO4, чтобы получить 1,5 н раствор? Решение:
Решив полученное уравнение, получим V =600 мл. ПРИЛОЖЕНИЕ 4 Расчеты при определении результатов титриметрического анализа Химические элементы и их соединения реагируют между собой в строго определенных массовых количествах, соответствующих их химическим эквивалентам. Для двух стехиометрически реагирующих веществ справедливо соотношение:
Соотношение (6) представляет собой следствие закона эквивалентов и является основным расчетным уравнением титриметрического анализа. Метод отдельных навесок. При титриметрическом определении этим методом навеску вещества растворяют в небольшом произвольном объеме растворителя и проводят титрование всего раствора. Зная объем, V (В), и нормальную концентрацию рабочего раствора, СН (В), израсходованного на реакцию взаимодействия с определяемым веществом, можно определить содержание определяемого компонента m( A) по формуле:
Метод пипетирования. Обычно в титриметрическом анализе навеску анализируемого вещества растворяют в мерной колбе определенного объема (V общ.) и для титрования берут не весь раствор, а только часть его (V a), аликвоту. Поэтому формула для расчета массы определяемого вещества имеет вид:
Для нахождения процентного содержания следует учесть массу навески m:
Пример. Навеску 0,1936 г железной руды перевели в раствор, восстановили железо до Fe(II) идовели объем раствора до 100 мл. Вычислить массовую долю Fe(II) в руде, если на титрование 10 мл полученного раствора в кислой среде израсходовано 8,75 мл 0,02н раствора K2Cr2O7. Решение. При титровании железа (П) раствором K2Cr2O7 в кислой среде протекает окислительно-восстановительная реакция, которая в ионном виде выглядит следующим образом: 6Fe2+ + Cr2O72– + 14H+ С учетом полуреакции Fe2+ – 1e ® Fe3+ находим фактор эквивалентности f (Fe2+) = 1 и вычисляем молярную массу эквивалента железа:
Мэ (Fe2+) = f ∙ М (Fe2+) = 55,85 × 1 = 55,85 г/моль- экв
Затем рассчитываем массу железа (П) в растворе и процентное содержание железа в руде:
Способы титрования В титриметрическом анализе различают прямое, обратное и косвенное титрование. Прямое титрование. Прямое титрование основано на том, что к определенному объему определяемого компонента по каплям приливают из бюретки стандартный раствор реагента (титранта). Окончание реакции узнают по изменению окраски индикатора или другим способом. Зная концентрацию раствора титранта и его количество, израсходованное на реакцию с определяемым веществом, можно легко вычислить содержание вещества (формулы 7,8). Обратное титрование.Этот прием состоит в том, что к определенному объему раствора определяемого компонента приливают точно измеренный объем стандартного раствора D, взятый в избытке. Избыток не вошедшего в реакцию стандартного раствора D оттитровывают стандартным раствором B(титрантом).
Пример 2. При определении содержания CaO в образце мела навеску в 0,1500 г обработали 50,00 мл 0,0999 М HCI, остаток кислоты оттитровали 10,00 мл NaOH (K =1,01). Вычислить массовую долю CaO в образце мела. Решение: CaO + изб. 2HCI = CaCI2 +H2O +ост. HCI ост. HCI + NaOH = NaCl + H2O Из условия задачи видно, что определение CaO проводилось методом обратного титрования. Поэтому для расчета массы CaO в образце мела выбираем формулу (6.3.3):
Косвенное титрование. В некоторых случаях прибегают к особому приему титрования, называемому косвенным, или титрованием заместителя. Сущность его заключается в том, что к определенному объему анализируемого раствора прибавляют какой-либо вспомогательный реагент, реагирующий с определяемым компонентом с выделением эквивалентного количества нового вещества (заместителя), которое оттитровывают раствором титранта. Например, K2Cr2O7определяют путем добавления к его раствору KI и H2SO4. Выделившийся в результате реакции I2 (заместитель)титруют раствором титранта Na2S2O3. При этом протекают следующие реакции:
Зная количество титранта Na2S2O3, израсходованное на реакцию с I2, количество которого эквивалентно количеству K2Cr2O7, нетрудно вычислить содержание дихромата калия в анализируемом растворе:
.
ОГЛАВЛЕНИЕ
ГЛАВА 1. ХРОМАТОГРАФИЯ.................................................................................................................................... 3 Введение........................................................................................................................................................................ 3 1. Сущность хроматографии................................................................................................................................... 4 2. Классификация хроматографических методов............................................................................................. 5 Вопросы для самоконтроля............................................................................................................................ 8 3. Ионообменная хроматография........................................................................................................................... 9 3.1. Обменная емкость ионитов........................................................................................................................ 10 3.2. Классификация ионитов............................................................................................................................. 11 3.3. Практическое применение ионообменной хроматографии............................................................. 12 Вопросы для самоконтроля.......................................................................................................................... 12 4. Плоскостная хроматография............................................................................................................................ 13 4.1. Тонкослойная хроматография................................................................................................................. 13 4.2. Бумажная хроматография......................................................................................................................... 16 Вопросы для самоконтроля.......................................................................................................................... 18 5. Газовая хроматография..................................................................................................................................... 18 5.1. Газотвердофазная хроматорафия........................................................................................................... 19 5.2. Газожидкостная хроматография............................................................................................................. 20 5.3. Аппаратурное оформление газовой хроматографии........................................................................ 21 5.3.1.Основные узлы газового хроматографа......................................................................................... 22 5.3.2. Детекторы............................................................................................................................................... 24 Вопросы для самоконтроля.......................................................................................................................... 25 5.4. Характеристики удерживания.................................................................................................................. 26 5. 5. Теоретические представления в газовой.............................................................................................. 28 хроматографии..................................................................................................................................................... 28 5.5.1. Теория эквивалентных теоретических тарелок........................................................................... 28 5.5.2. Кинетическая теория........................................................................................................................... 29 5.5.3. Оценка эффективности, селективности и разделительной....................................................... 31 способности хроматографических колонок............................................................................................ 31 Вопросы для самоконтроля.......................................................................................................................... 32 5.6. Качественный анализ................................................................................................................................. 32 5.7. Количественный анализ............................................................................................................................. 34 5.8. Практическое применение газовой хроматографии........................................................................... 36 Вопросы для самоконтроля.......................................................................................................................... 37 6. Жидкостная колоночная хроматография..................................................................................................... 38 6.1. Адсорбционная хроматография.............................................................................................................. 38 6.2. Распределительная хроматография....................................................................................................... 40 6.3. Эксклюзионная хроматография............................................................................................................... 41 6.4. Особенности жидкостных хроматографов........................................................................................... 42 Вопросы для самоконтроля.......................................................................................................................... 43 ЛИТЕРАТУРА............................................................................................................................................................ 64 ГЛАВА 2. ПРАКТИЧЕСКИЕ РАБОТЫ.................................................................................................................... 45 Газожидкостная хроматография............................................................................................................ 45 Работа 1. Определение качественного состава смеси на основе...................................................... 45 характеристик удерживания........................................................................................................................ 45 Характеристики удерживания.............................................................................................................................. 45 Работа 2. Определение количественного состава................................................................................. 48 многокомпонентной смеси............................................................................................................................ 48 Работа 3. Определение критериев разделения........................................................................................ 50 ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ........................................................................................................... 52 Работа 1. Определение содержания в растворе нейтральных солей............................................... 52 Работа 2. Определение динамической обменной емкости катионита............................................. 53 Работа 3. Определение ионов никеля и цинка в смеси.......................................................................... 55 с использованием разделения их на анионите........................................................................................ 55 ТОНКОСЛОЙНАЯ ХРОМАТОГРАФИЯ............................................................................................................ 56 Работа 1. Разделение и обнаружение галогенидов............................................................................... 56 БУМАЖНАЯ ХРОМАТОГРАФИЯ...................................................................................................................... 59 Работа 1. Разделение железа (III) и меди (II).......................................................................................... 59 Работа 2. Разделение смеси аминокислот................................................................................................ 61 ЛИТЕРАТУРА................................................................................................................................................................ 65 ПРИЛОЖЕНИЕ 1........................................................................................................................................................... 64 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ............................................................................................................................. 65 Газовая хроматография................................................................................................................................. 65 Ионообменная хроматография.................................................................................................................... 66 Плоскостная хроматография....................................................................................................................... 68 ПРИЛОЖЕНИЕ 2........................................................................................................................................................... 69 СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ................................................................................................. 69 ПРИЛОЖЕНИЕ 3........................................................................................................................................................... 73 РАСЧЕТЫ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРОВ......................................................................................... 73 ПРИЛОЖЕНИЕ 4........................................................................................................................................................... 75 РАСЧЕТЫ ПРИ ОПРЕДЕЛЕНИИ РЕЗУЛЬТАТОВ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА................... 75 ОГЛАВЛЕНИЕ............................................................................................................................................................... 78
Учебное издание
Татьяна Михайловна Гиндуллина Надежда Михайловна Дубова
|


 или
или  (6)
(6) ,(г) (7)
,(г) (7)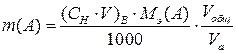 , (г) (8)
, (г) (8)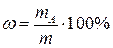 (9)
(9) 6Fe3+ + 2Cr3+ + 7H2O
6Fe3+ + 2Cr3+ + 7H2O г
г