Д.и. менделеева
Задание. Для подчеркнутого элемента, атом которого образует молекулу (см. вариант в табл. 3): 1) напишите электронную формулу, подчеркните валентные электроны и определите семейство; 2) распределите валентные электроны по энергетическим ячейкам для атома, находящегося в основном и возбужденном состояниях; определите возможную валентность атома в каждом состоянии; 3) укажите значения квантовых чисел для валентных электронов; 4) объясните связь электронного строения атома элемента с его положением в периодической системе (период, группа, подгруппа); 5) определите степени окисления элементов в молекуле; 6) составьте электронную формулу для центрального атома в молекуле, находящегося в соответствующей степени окисления; 7) охарактеризуйте окислительно-восстановительную способность атома элемента с заданной степенью окисления.
Таблица 3
Тема 3
Основные закономерности Задание. Дано уравнение реакции (см. вариант в табл. 4). 1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 2. Вычислите изменение энтальпии реакции 3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 5. Определите температуру, при которой реакция находится в равновесии (Т р). 6. Рассчитайте 7. Постройте график зависимости 8. Вычислите значения константы равновесия K c при температурах Т р, Т 1 и Т 2. Cделайте вывод о влиянии температуры на величину K c и на смещение химического равновесия.
Тема 4
|

 и
и  .
.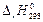 и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции. . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак  и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции. при Т 1 = Т р–100, Т 2 = Т р+100.
при Т 1 = Т р–100, Т 2 = Т р+100.


