Референтные величины концентрации 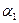 -антитрипсина в сыворотке крови: у взрослых до 60 лет 0,78—2 г/л, старше 60 лет 1,15—2 г/л.
-антитрипсина в сыворотке крови: у взрослых до 60 лет 0,78—2 г/л, старше 60 лет 1,15—2 г/л.
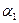 -антитрипсина — гликопротеид, синтезируемый печенью и обеспечивающий 90% активности, ингибирующей трипсин в крови. Этот гликопротеид ингибирует действие не только трипсина, но и химотрипсина, эластазы, калликреина, катепсинов и других тканевых протеаз, способствуя их расщеплению.
-антитрипсина — гликопротеид, синтезируемый печенью и обеспечивающий 90% активности, ингибирующей трипсин в крови. Этот гликопротеид ингибирует действие не только трипсина, но и химотрипсина, эластазы, калликреина, катепсинов и других тканевых протеаз, способствуя их расщеплению.
Описано множество изоформ этого фермента, кодируемых различными аллелями. У одного человека в крови можно обнаружить одну или две формы 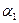 - антитрипсина. Наиболее распространена М-форма. Образование Z-формы (называемой так из-за её особой электрофоретической подвижности в геле) связано с генной мутацией, приводящей к замене одной из-за аминокислот в М-белке. Z -белок с трудом высвобождается из клеток печени и вызывает локальные повреждения, которые могут приводить к гепатиту и циррозу. Для определения концентрации
- антитрипсина. Наиболее распространена М-форма. Образование Z-формы (называемой так из-за её особой электрофоретической подвижности в геле) связано с генной мутацией, приводящей к замене одной из-за аминокислот в М-белке. Z -белок с трудом высвобождается из клеток печени и вызывает локальные повреждения, которые могут приводить к гепатиту и циррозу. Для определения концентрации 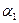 -антитрипсина в сыворотке крови применяют метод нефелометрии. Установление формы
-антитрипсина в сыворотке крови применяют метод нефелометрии. Установление формы 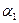 -антитрипсина (ZZ,MM,MZ,FZ) проводят с помощью электрофореза или молекулярно-генетических методов.
-антитрипсина (ZZ,MM,MZ,FZ) проводят с помощью электрофореза или молекулярно-генетических методов.
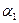 -антитрипсин относится к белкам острой фазы, поэтому его содержание в сыворотке крови повышается при воспалительных процессах (острые, подострые и хронические инфекционные заболевания, острые гепатиты и цирроз печени в активной фазе, некротические процессы, состояния после операции, восстановительная фаза термических ожогов, вакцинация). Содержание
-антитрипсин относится к белкам острой фазы, поэтому его содержание в сыворотке крови повышается при воспалительных процессах (острые, подострые и хронические инфекционные заболевания, острые гепатиты и цирроз печени в активной фазе, некротические процессы, состояния после операции, восстановительная фаза термических ожогов, вакцинация). Содержание 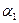 -антитрипсина в сыворотке крови повышается при злокачественных новообразованиях: раке (особенно шейки матки) и метастазах, лимфомах (особенно лимфогранулематозе).
-антитрипсина в сыворотке крови повышается при злокачественных новообразованиях: раке (особенно шейки матки) и метастазах, лимфомах (особенно лимфогранулематозе).
Особый интерес представляют случаи снижения концентрации 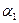 -антитринсина в сыворотке крови. У пациентов, гомозиготных по аллелю Z, развиваются тяжелые поражения печени — неонатальный гепатит, цирроз печени. Выраженная недостаточность
-антитринсина в сыворотке крови. У пациентов, гомозиготных по аллелю Z, развиваются тяжелые поражения печени — неонатальный гепатит, цирроз печени. Выраженная недостаточность 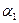 -антитрипсина часто сочетается с ювенильной базальной эмфиземой лёгких, ранним развитием эмфиземы (в возрасте 20-40 лет). Довольно часто наблюдают стёртые формы врожденной недостаточности
-антитрипсина часто сочетается с ювенильной базальной эмфиземой лёгких, ранним развитием эмфиземы (в возрасте 20-40 лет). Довольно часто наблюдают стёртые формы врожденной недостаточности 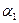 -антитрипсина (MZ-фенотип). У таких детей обнаруживают различные формы поражения печени, включая ранние холестазы. У 1-2% больных развивается цирроз печени.
-антитрипсина (MZ-фенотип). У таких детей обнаруживают различные формы поражения печени, включая ранние холестазы. У 1-2% больных развивается цирроз печени.
Распространённость гомозиготности по Z-аллели составляет приблизительно 1:3000. В таких случаях активность 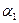 -антитрипсина в сыворотке крови снижена до 10-15% нормальных значений. Не у всех лиц, гомозиготных по Z-аллели, развиваются заболевания лёгких и печени. Риск развития эмфиземы значительно повышается у курящих, поскольку сигаретный дым окисляет тиоловую группу активного участка в молекуле
-антитрипсина в сыворотке крови снижена до 10-15% нормальных значений. Не у всех лиц, гомозиготных по Z-аллели, развиваются заболевания лёгких и печени. Риск развития эмфиземы значительно повышается у курящих, поскольку сигаретный дым окисляет тиоловую группу активного участка в молекуле 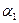 -антитрипсина, что снижает активность присутствующего в небольших количествах фермента. Несмотря на, то что
-антитрипсина, что снижает активность присутствующего в небольших количествах фермента. Несмотря на, то что 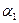 -антитрипсин относится к белкам острой фазы, его концентрация у гомозигот по Z-аллели никогда не поднимается выше 50% нижней границы нормы.
-антитрипсин относится к белкам острой фазы, его концентрация у гомозигот по Z-аллели никогда не поднимается выше 50% нижней границы нормы.
У лиц с MZ -формой 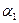 -антитрипсина его активность в сыворотке крови составляет примерно 60% нормы, поэтому риск развития заболеваний легких у них существенно ниже по сравнению с людьми, гомозиготными по Z-аллели.
-антитрипсина его активность в сыворотке крови составляет примерно 60% нормы, поэтому риск развития заболеваний легких у них существенно ниже по сравнению с людьми, гомозиготными по Z-аллели.
Приобретённую недостаточность 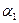 -антитрипсина наблюдают при нефротическом синдроме, гастроэнтеропатии с потерей белка, острой фазе термических ожогов. Снижение концентрации
-антитрипсина наблюдают при нефротическом синдроме, гастроэнтеропатии с потерей белка, острой фазе термических ожогов. Снижение концентрации 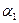 -антитрипсина в крови возможно у больных вирусным гепатитом вследствие нарушения его синтеза в печени, а также при респираторном дистресс-синдроме, остром панкреатите, коагулопатиях в связи с повышенным расходом этого гликопротеида.
-антитрипсина в крови возможно у больных вирусным гепатитом вследствие нарушения его синтеза в печени, а также при респираторном дистресс-синдроме, остром панкреатите, коагулопатиях в связи с повышенным расходом этого гликопротеида.
3.4 Церулоплазмин (медьсодержащая осидаза) в сыворотке крови.
Референтные величины концентрации церулоплазмина в сыворотке крови у взрослых составляют 180—450 мг/л.
Церулоплазмин — белок с молекулярной массой 150 000 дальтон, содержит 8 ионов 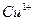 и 8 ионов
и 8 ионов 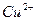 . Главный медьсодержащий белок плазмы относиться к ά2-глобулинам; на его долю приходится 3% общего количества меди в организме и свыше 95% меди сыворотки крови. Церулоплазмин обладает выраженной оксидазной активностью; в плазме он также ограничивает освобождение запасов железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, а также инактивирует активные формы кислорода, предотвращая перекисное окисление липидов.
. Главный медьсодержащий белок плазмы относиться к ά2-глобулинам; на его долю приходится 3% общего количества меди в организме и свыше 95% меди сыворотки крови. Церулоплазмин обладает выраженной оксидазной активностью; в плазме он также ограничивает освобождение запасов железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, а также инактивирует активные формы кислорода, предотвращая перекисное окисление липидов.
Недостаточность церулогплазмина вследствие нарушения его синтеза в печени вызывает болезнь Уилсона—Коновалова (гепатоцеребральная дегенерация). При недостаточности церулоплазмина ионы меди выходят внесосудистое пространство (содержание меди в крови также снижается). Они проходят через базальные мембраны почек в гломерулярны фильтрат и выводятся с мочой или накапливаются в соединительной ткани (например, в роговице). Особое значение имеет накопление меди в ЦНС. Недостаточность ионов меди в крови (вследствие дефицита церулоплазмина) приводит к повышению их резорбции в кишечнике, что ещё больше способствует её накоплению в организме с последующим воздействием на ряд жизненно важных процессов. Снижение концентрации церулоплазмина в крови выявляют у 97% пациентов с болезнью Уилсона—Коновалова. Снижение содержания церулоплазмина в сыворотке крови также отмечают также при нефротическом синдроме, заболеваниях ЖКТ, тяжёлых поражениях печени (в 23% случаев) вследствие его потерь и нарушениях синтеза.
Церулоплазмин относится к белкам острой фазы (период полураспада 6 сут.), поэтому возрастание его концентрации в крови наблюдают у больных с острыми и хроническими инфекционными заболеваниям циррозом печени, гепатитами, ИМ, системными заболеваниями, лимфогранулематозом. Повышение уровня церулоплазмина отмечено у больных шизофренией.
Содержание церулоплазмина в сыворотке крови при злокачественных новообразованиях различной локализации (рак лёгкого, молочной железы, шейки матки, ЖКТ) увеличивается (в среднем в 1,5—2 раза), особенно при распространении процесса. Успешная химио- и лучевая терапия способствуют снижению содержания церулоплазмина в крови, вплоть до нормализации. При неэффективности терапии, а также при прогрессировании заболевания содержание церулоплазмина остаётся высоким.

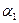 -антитрипсина в сыворотке крови: у взрослых до 60 лет 0,78—2 г/л, старше 60 лет 1,15—2 г/л.
-антитрипсина в сыворотке крови: у взрослых до 60 лет 0,78—2 г/л, старше 60 лет 1,15—2 г/л.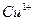 и 8 ионов
и 8 ионов 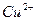 . Главный медьсодержащий белок плазмы относиться к ά2-глобулинам; на его долю приходится 3% общего количества меди в организме и свыше 95% меди сыворотки крови. Церулоплазмин обладает выраженной оксидазной активностью; в плазме он также ограничивает освобождение запасов железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, а также инактивирует активные формы кислорода, предотвращая перекисное окисление липидов.
. Главный медьсодержащий белок плазмы относиться к ά2-глобулинам; на его долю приходится 3% общего количества меди в организме и свыше 95% меди сыворотки крови. Церулоплазмин обладает выраженной оксидазной активностью; в плазме он также ограничивает освобождение запасов железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, а также инактивирует активные формы кислорода, предотвращая перекисное окисление липидов.


